
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。
(1)硫酸厂的酸性废水中砷(As)元素(主要以H3AsO3形式存在)含量极高,为控制砷的排放,某工厂采用化学沉淀法处理含砷废水。请回答以下问题:
①已知砷是氮的同族元素,比氮原子多2个电子层,砷在元素周期表的位置为____________。
②工业上采用硫化法(通常用硫化钠)去除废水中的砷,生成物为难溶性的三硫化二砷,该反应的离子方程式为_____________________。
(2)电镀厂的废水中含有的CN-有剧毒,需要处理加以排放。处理含CN-废水的方法之一是在微生物的作用下,CN-被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为_____________。
(3)电渗析法处理厨房垃极发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子):
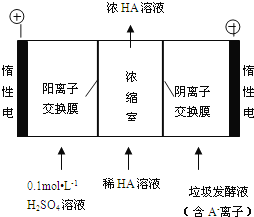
①阳极的电极反应式为________________________。
②简述浓缩室中得到浓乳酸的原理:________________________。
③电解过程中,采取一定的措施可控制阳极室的pH约为6~8,此时进入浓缩室的OH-可忽略不计。400 mL 10 g/L 乳酸溶液通电一段时间后,浓度上升为145 g/L(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为________L(提示:乳酸的摩尔质量为90 g/mol)。
【答案】第四周期第ⅤA族2H3AsO3+3S2-+6H+═As2S3↓+6H2O4H2O+2CN-+O2═2HCO3-+2NH32H2O-4e-═4H++O2↑阳极H2O放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室,A-从阴极通过阴离子交换膜进入浓缩室,H++A-═HA,乳酸浓度增大6.72
【解析】
(1)①砷原子电子层数=周期数=4,最外层电子数=族序数=5,所以砷位于第四周期第ⅤA族;因此本题答案是:第四周期第ⅤA族。
②根据信息:硫化钠可以和废水中的砷反应,生成难溶性的三硫化二砷,据此得到反应的离子方程式为:2H3AsO3+3S2-+6H+═As2S3↓+6H2O;因此,本题答案是:2H3AsO3+3S2-+6H+═As2S3↓+6H2O。
(2)CN-被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为:4H2O+2CN-+O2═2HCO3-+2NH3;因此,本题答案是:4H2O+2CN-+O2═2HCO3-+2NH3。
(3) ①阳极上是氢氧根离子失电子发生氧化反应,电极反应式为:2H2O-4e-═4H++O2↑ ;因此本题答案是:2H2O-4e-═4H++O2↑。
②在电解池的阳极上是氢氧根放电,所以c(H+)增大,并且H+从阳极通过阳离子交换膜进入浓缩室;根据电解原理,电解池中的阴离子移向阳极,即 A-通过阴离子交换膜从阴极进入浓缩室,发生反应:H++A-═HA,使乳酸浓度增大;综上所述,本题答案是:阳极H2O放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室,A-从阴极通过阴离子交换膜进入浓缩室,H++A-═HA,乳酸浓度增大。
③在阳极上发生电极反应:4OH—-4e-=2H2O+O2↑,阴极上发生电极反应:2H++2e-=H2↑,根据电极反应方程式,则有:HA—H+--1/2H2,据差值法,乳酸的浓度变化量是(145-10)/90=1.5mol/L,即生成HA的物质的量是1.5×0.4=0.6mol,即产生氢气0.3mol,即0.3×22.4=6.72L;综上所述,本题答案是:6.72L。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】为测定含镁3%~5%的铝镁合金中镁的质量分数,设计了2种实验方案,说法不正确的是
方案一:镁铝合金加入足量的氢氧化钠溶液中充分反应后过滤,测定剩余固体质量;
方案二:称量m g铝镁合金粉末,放在图中惰性电热板上,通电使其充分灼烧。测得固体质量增重。
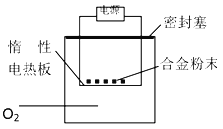
A. 方案一中若称取5.4 g合金粉末样品,投入V mL 2.0 mol/L NaOH溶液中反应,则V≥100 mL
B. 方案一中测定剩余固体质量时,过滤后未洗涤固体就干燥、称量,则镁的质量分数偏高
C. 方案二中欲计算镁的质量分数,实验中还需测定灼烧后固体的质量
D. 方案二中若用空气代替O2进行实验,则测定结果偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙烯醇肉桂酸酯G可用于光刻工艺中作抗腐蚀涂层。下面是一种合成该有机物的路线(部分反应条件及产物已省略):
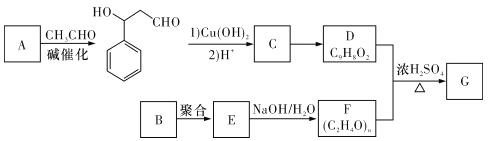
已知以下信息:
I.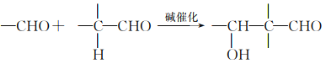 ;
;
Ⅱ.D能使酸性KMnO4溶液褪色;
Ⅲ.同温同压下,实验测定B气体的密度与气态己烷的密度相同,B中含有一个酯基和一个甲基。
请回答下列问题:
(I)A的化学名称是_________。
(2)由C生成D的过程中可能生成多种副产物,其中与D互为同分异构体的有机物的结构简式为______。
(3)B的分子式为__________。
(4)由D和F生成G的化学方程式为_____________。
(5)满足下列条件的C的同分异构体有________种(不考虑立体异构)。
①该有机物是一种二元弱酸,并能使FeC13溶液显色;
②苯环上有三个取代基,并能发生银镜反应。
(6)由D经如下步骤可合成K:
![]()
①H中官能团的名称为 _______________。
②I的结构简式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500mLKNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是
A.电解得到的Cu的物质的量为0.5mol
B.向电解后的溶液中加入98g的Cu(OH)2可恢复为原溶液
C.原混合溶液中c(K+)=4mol/L
D.电解后溶液中c(H+)=2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种短周期主族元素,其原子半径随原子序数的变化如图。已知W是地壳中含量最高的元素;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是
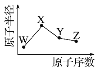
A. 对应的简单离子的半径:X<W
B. 对应的简单气态氢化物的稳定性:Y>Z
C. 元素X、Z分别与W能形成多种化合物
D. Z的最高价氧化物对应的水化物具有强酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为__________________________。
(2)反应AX3(g)+X2(g)![]() AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
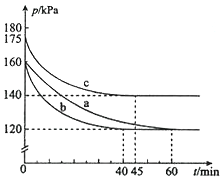
①实验a从反应开始至达到平衡时的反应速率v(AX5)=________(保留两位有效数字)。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为___________ (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:
b____________________、c____________________。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是![]()
![]()
![]() 杂化轨道是由同一个原子中能量最近的s轨道和p轨道混合起来形成的一组能量相同的新轨道
杂化轨道是由同一个原子中能量最近的s轨道和p轨道混合起来形成的一组能量相同的新轨道
![]() 同一周期从左到右,元素的第一电离能、电负性都是越来越大
同一周期从左到右,元素的第一电离能、电负性都是越来越大
![]() 分子中键能越大,表示分子拥有的能量越高
分子中键能越大,表示分子拥有的能量越高
![]() 所有的配合物都存在配位键
所有的配合物都存在配位键
![]() 所有含极性键的分子都是极性分子
所有含极性键的分子都是极性分子
![]() 熔融状态下能导电的化合物一定是离子化合物
熔融状态下能导电的化合物一定是离子化合物
![]() 所有的原子晶体都不导电
所有的原子晶体都不导电
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 一定条件下,乙酸乙酯、淀粉、蛋白质、乙烯都能与水发生水解反应
B. 全降解塑料(![]() )可由单体环氧丙烷(
)可由单体环氧丙烷(![]() )和CO2聚合制得
)和CO2聚合制得
C. 淀粉溶液中加入硫酸,加热4~5 min,再加入少量银氨溶液,加热,有光亮银镜生成
D. 石油的裂化、煤的气化与液化都属于化学变化,而石油的分馏与煤的干馏都属于物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物物G是一种用于合成γ-分泌调节剂的药物中间体,其合成路线流程图如下:
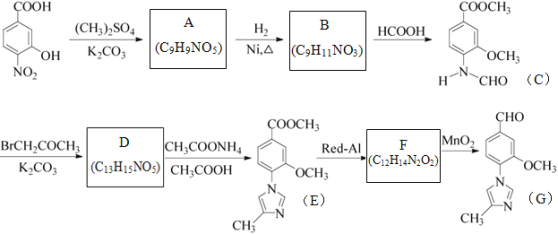
已知:![]()
请回答:
(1)B的结构简式为___________________。
(2)下列说法正确的是__________________。
A.化合物A能与FeCl3溶液发生显色反应
B.1mol化合物C最多能与2molNaOH反应
C.化合物E既有氧化性,又有还原性
D.由流程可知,Red-Al、MnO2分别做还原剂、氧化剂,其中MnO2也可用Cu/O2、足量的酸性高锰酸钾等代替
E.化合物G的最简式为C6H6NO
(3)C→D的过程中有一种无色无味气体产生,其化学方程式为____________________。
(4)写出同时满足下列条件的B的同分异构体的结构简式____________________。
①含有苯环,且分子中有一个手性碳原子;
②能发生水解反应,水解产物之一是α-氨基酸,另一水解产物分子中只有2种不同化学环境的氢。
(5)已知: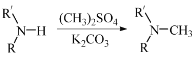 (R代表烃基,R'代表烃基或H)。请写出以
(R代表烃基,R'代表烃基或H)。请写出以![]() 、
、![]() 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) _________。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) _________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com