
|
| A.从E口逸出的气体是H2 |
| B.从B中加入含少量NaOH的水溶液以增强导电性 |
| C.标准状况下每生成22.4L Cl2,便产生2mol NaOH |
| D.向电解后的阴极溶液中加适量盐酸,可以 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
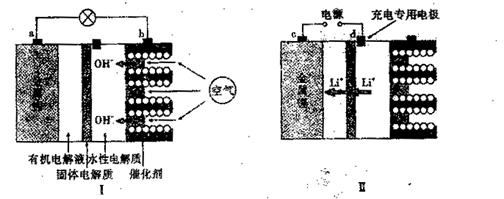
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
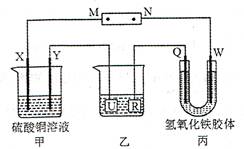
| A.电源的M 极为正极 |
| B.甲装置中溶液的pH 减小 |
| C.甲装置的两个电极上都有单质生成且物质的量之比为1︰1 |
| D.欲用乙装置给铜镀银,U 极应该是Ag,电镀液选择AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.KNO3 | B.NaCl | C.AgNO3 | D.CuCl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 AsO33-+I2+H2O是可逆反应。现设计如下图所示实验装置(装置中盐桥的作用是使整个装置形成一个闭合的回路)进行下述操作:
AsO33-+I2+H2O是可逆反应。现设计如下图所示实验装置(装置中盐桥的作用是使整个装置形成一个闭合的回路)进行下述操作: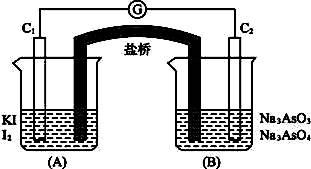
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用明矾净水是因为Al2+水解生成的Al(OH)3胶粒具有很强的吸附性 |
| B.合成氨生成过程中,采用高温高压都是为了提高N2、H2转化率 |
| C.往铁钉镀铜时,用铜做阴极 |
| D.电解饱和食盐水制烧碱,NaOH在阳极区域产生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.往下水道中倾倒硫酸铜溶液,会进一步加快铁制管道的腐蚀 |
| B.镁与稀盐酸反应剧烈,加入醋酸钠晶体可以减慢反应速率 |
| C.电解饱和食盐水制氯气时用铁作阳极 |
| D.电解法精炼粗铜,用纯铜作阴极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 后,两极均得到标况下11.2L气体,则原混合液中CuSO4的物质的量浓度为( )
后,两极均得到标况下11.2L气体,则原混合液中CuSO4的物质的量浓度为( )| A.0.5mol·L-1 | B.0.8mol·L-1 | C.1.0mol·L-1 | D.1.5mol·L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com