
【题目】能正确表达下列反应的离子方程式为( )
A.用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
B.硫化亚铁与浓硫酸混合加热:2H++FeS=H2S↑+ Fe2+
C.向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3 ![]() =Al2(CO3)3↓
=Al2(CO3)3↓
D.用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH= ![]() +
+ ![]() + H2O
+ H2O
【答案】D
【解析】解:A.碳酸钙和醋酸都需要保留化学式,正确的离子方程式为CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO﹣ , 故A错误;B.硫化亚铁与浓硫酸混合加热,离子方程式为2FeS+20H++7SO42﹣=2Fe3++9SO2↑+10H2O,故B错误;
C.铝离子水解显酸性,碳酸根离子水解显碱性,混合后水解相互促进生成氢氧化铝和二氧化碳,反应的离子方程式为2Al3++3CO32﹣+3H2O=2Al(OH)3↓+3CO2↑,故C错误;
D.用氢氧化钠溶液吸收工业废气中的NO2 , +4价的氮发生歧化反应,生成硝酸钠、亚硝酸钠,离子方程式为2NO2+2OH﹣=NO3﹣+NO2﹣+H2O,故D正确;
故选D.


科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“ ![]() ”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
A. Ts是第七周期第ⅦA族元素 B. Ts的同位素原子具有相同的电子数
C. Ts在同族元素中非金属性最弱 D. 中子数为176的TS核素符号是 ![]() Ts
Ts
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天宫一号搭载的长征二号火箭使用的主要燃料是偏二甲肼(用R表示,其中碳元素显﹣2价、氮元素显﹣2价),N2O4作氧化剂,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为:R + 2N2O4 = 3N2↑+ 4H2O↑+ 2CO2↑,下列叙述错误的是( )
A. 燃烧反应放出的巨大能量,把火箭送入太空
B. N2既是氧化产物也是还原产物,CO2是氧化产物
C. 每生成1mol N2,该反应转移电子8mol
D. 此反应中R的分子式为C2H8N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取NaHCO3和Na2O2的固体混合物x g放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如图所示.试回答下列问题: 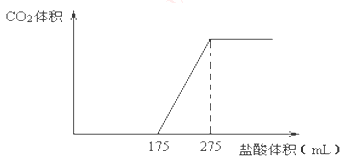
(1)加入盐酸后总共产生的气体在标准状况下的体积为L;
(2)盐酸中HCl的物质的量浓度;
(3)反应后的固体的成分(填化学式);
(4)x= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有丰富的Na+、Mg2+、Cl﹣、Br﹣等化学资源.将海水淡化与浓缩海水结合是综合利用海水资源的途径之一.以浓缩海水为原料,通过一系列工艺流程可以提取Mg、Br2等产品.
(1)如图是采用膜分离技术的海水淡化示意图.淡化膜可以让水分子通过,而海水中其他分子和离子均不能通过.加压后,左侧淡水中增加的是(填字母). 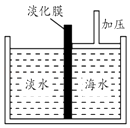
a.溶质质量 b.溶剂质量 c.溶质的质量分数
(2)从海水中提取镁的主要步骤如下: 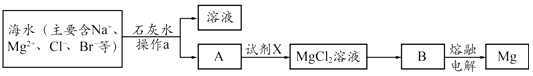
①操作a的名称是 .
②写出B冶炼金属镁的化学方程式 .
(3)空气吹出法是用于工业规模海水提溴的常用方法,其中一种工艺是以预先经过酸化的浓缩海水为原料,通过以下步骤提取溴: 步骤一:用氯气置换溴离子使之成为单质溴;
步骤二:通入空气和水蒸气,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用转化成氢溴酸;
步骤三:用氯气将氢溴酸氧化得到产品溴.
①步骤一和步骤二的目的是 .
②步骤二中发生反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.48gFe3O4完全溶解于100mL1mol/L硫酸中,然后加入K2Cr2O7溶液25mL,恰好使溶液中Fe2+全部转化为Fe3+ , Cr2O72﹣全部还原为Cr3+ , 则K2Cr2O7溶液的物质的量浓度为( )
A.0.05mol/L
B.0.1mol/L
C.0.2mol/L
D.0.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g).CO和H2O(g)浓度变化如图 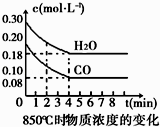
(1)0~4min的平均反应速率v(CO)=molL﹣1min﹣1 .
(2)该条件下,此反应的平衡常数K=(写表达式).
(3)该反应平衡时CO的转化率为 .
(4)能判断该反应达到化学平衡状态的依据是 . A.容器中压强不变 B.混合气体中c(CO)不变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
若降低温度,该反应的K值将 , 该反应的化学反应速率将(填“增大”“减小”或“不变”).
(5)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0J062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①c1数值0.08molL﹣1(填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能的原因是 , 表中5min~6min之间数值发生变化,可能的原因是 .
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com