
在硫酸工业中,通过下列反应使SO2氧化成SO3:
2SO2(g)+O2(g)
 2SO3(g) ΔH=-198 kJ·mol-1。(已知制SO3过程中催化剂是V2O5,它在400℃~500℃时催化效果最好)
2SO3(g) ΔH=-198 kJ·mol-1。(已知制SO3过程中催化剂是V2O5,它在400℃~500℃时催化效果最好)
下表为不同温度和压强下SO2的转化率(%):
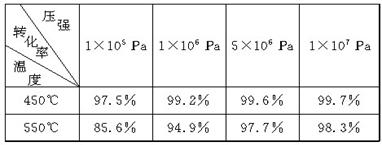
(1)根据化学理论综合分析,为了使二氧化硫尽可能转化为三氧化硫,可控制的条件是________________________________________________________________________。
(2)实际生产中,选定400℃~500℃作为操作温度,其原因是
________________________________________________________________________。
(3) 实际生产中,采用的压强为常压,其原因是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(4) 在生产中,通入过量空气的目的是
________________________________________________________________________
________________________________________________________________________。
(5)尾气中有SO2,必须回收是为了
________________________________________________________________________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
对右图两种化合物的结构或性质描述正确的是( )。
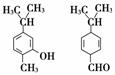
A.不是同分异构体
B.分子中共平面的碳原子数相同
C.均能与溴水反应
D.可用红外光谱区分,但不能用核磁共振氢谱区分
查看答案和解析>>
科目:高中化学 来源: 题型:
设C(s)+CO2(g)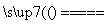 2CO(g)(ΔH=Q1 kJ·mol-1)反应速率为v1,N2(g)+3H2(g)
2CO(g)(ΔH=Q1 kJ·mol-1)反应速率为v1,N2(g)+3H2(g)
 2NH3(g)(ΔH=-Q2 kJ·mol-1)反应速率为v2,对于上述两个反应,当温度升高时,v1和v2的变化情况为( )
2NH3(g)(ΔH=-Q2 kJ·mol-1)反应速率为v2,对于上述两个反应,当温度升高时,v1和v2的变化情况为( )
A.同时增大 B.同时减小
C.v1增大,v2减小 D.v1减小,v2增大
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示容积固定的密闭容器中进行的某一可逆反应:A(g)+2B(g)
 2C(g),以B浓度表示反应速率与时间的关系,已知速率单位为mol·L-1·s-1,图中阴影面积的数值相当于( )
2C(g),以B浓度表示反应速率与时间的关系,已知速率单位为mol·L-1·s-1,图中阴影面积的数值相当于( )
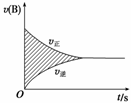
A.A浓度的减少量 B.B浓度的减少量
C.C物质的量的增加量 D.B物质的量的减少量
查看答案和解析>>
科目:高中化学 来源: 题型:
关于工业合成氨的叙述中,错误的是( )
A.在动力、设备、材料允许的情况下,反应尽可能在高压下进行
B.温度越高越有利于工业合成氨
C.在工业合成氨中N2、H2的循环利用可提高其利用率,降低成本
D.及时从反应体系中分离出氨气有利于平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他电极均为Cu,则 ( )
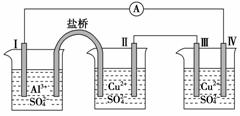
A. 电流方向:电极Ⅳ→Ⓐ→电极Ⅰ
B. 电极Ⅰ发生还原反应
C. 电极Ⅱ逐渐溶解
D. 电极Ⅲ的电极反应:Cu2++2e-===Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极按如图中装置完成实验,其中A、B两烧杯分别盛放200 g 10% NaOH溶液和足量CuSO4溶液。通电一段时间后,c极上有Cu析出,又测得A烧杯溶液中NaOH的质量分数为10.23%。试回答下列问题:
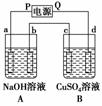
(1)电源的P极为________极。
(2)b极产生气体的体积为________L(标准状况)。
(3)c极上析出沉淀的质量为________g。
(4)d极上所发生的电极反应为__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚锡(SnSO4)可用于镀锡工业。某小组设计SnSO4制备路线为
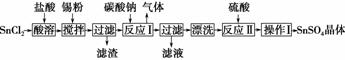
查阅资料:
Ⅰ.锡在酸性溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡。
(1)锡原子的核电荷数为50,与碳元素同处 ⅣA族,锡位于周期表的第________周期。
(2)操作Ⅰ是 ________、过滤和洗涤等。
(3)溶解SnCl2粉末时需加浓盐酸,原因为__________________________________________________________。
(4)加入Sn粉的作用为①调节溶液pH,②__________________________________________________________。
(5)反应Ⅰ所得沉淀是SnO,其化学反应方程式:__________________________________________________________。
(6)酸性条件下,SnSO4与双氧水反应的离子方程式:__________________________________________________________。
(7)该小组通过下列方法可测定该锡粉的纯度:
①将试样溶于盐酸,反应为Sn+2HCl===SnCl2+H2↑
②加入过量的FeCl3
③用已知浓度的K2Cr2O7滴定②中生成的Fe2+,再计算锡粉的纯度,请配平反应:
FeCl2+____K2Cr2O7+____HCl===____FeCl3+____KCl+____CrCl3+____
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,在1.0 L浓度均为0.01 mol·L-1的某一元酸HA与其钠盐组成的混合溶液中,测得c(Na+)>c(A-),则下列描述中,不正确的是( )
A.该溶液的pH<7
B.HA的酸性很弱,A-的水解程度较大
C.c(A-)+c(HA)=0.02 mol·L-1
D.n(A-)+n(OH-)=0.01 mol+n(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com