
(1)1.00 mol FeS2完全氧化,需要空气的体积(标准状况)为________ L。
(2)55 L空气和足量FeS2完全反应后,气体体积(同温同压)变为________ L。
(3)用空气氧化FeS2产生的气体混合物中,O2的含量为0.0800,计算SO2的含量。
(4)设FeS2氧化产生的气体混合物为100 L,其中O2为a L,SO2为b L。
①写出a和b的关系式。
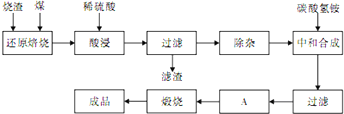
②在下图中画出a和b的关系曲线(FeS2氧化时,空气过量20%)。

说明:为方便作图,纵坐标用13b表示。
解析:(1)1.00 mol FeS2完全氧化,需要空气的体积(标准状况)为1 mol×![]() ×22.4 L·mol-1×
×22.4 L·mol-1×![]() =308 L。
=308 L。
(2)11O2 ~ 8SO2 气体体积减小
11 8 3
55 L×0.200 ![]()
![]() =
=![]() =3 L
=3 L
反应后的气体体积为55 L-3 L=52 L。
(3)设反应后总体积为1 L,SO2的体积分数为x,则SO2的体积为x,剩余O2的体积为0.0800 L。由化学方程式可求出参加反应的O2的体积为![]() x,则反应前O2的总体积为0.0800 L+
x,则反应前O2的总体积为0.0800 L+![]() x,空气中氮气的体积为氧气体积的4倍,氮气体积为4×(0.0800 L+
x,空气中氮气的体积为氧气体积的4倍,氮气体积为4×(0.0800 L+![]() x)。据题意可建立等式:4×(0.0800 L+
x)。据题意可建立等式:4×(0.0800 L+![]() x)=1-0.0800-x,求得x=0.0923。
x)=1-0.0800-x,求得x=0.0923。
(4)①根据(3)的思路,按反应前后氮气的体积相等可得:4×(a L+![]() b L)=100-a-b,整理即得:13b=200-10a。
b L)=100-a-b,整理即得:13b=200-10a。
②当生成的混合气体中不含SO2,即13b=0时,此时100 L全部为空气,显然a= 20 L。20 L为a取值的上限,但a的下限并不是为0,因题中明确了空气过量20%。求解a的下限如下:设参加反应的空气为100 L,则过量的空气为20 L。生成的SO2为100 L×0.200×![]() =14.55 L,生成气体中氮气的体积不变,为120×0.800=96 L,过量的O2的体积为20×0.200=4 L。则a=100 L×
=14.55 L,生成气体中氮气的体积不变,为120×0.800=96 L,过量的O2的体积为20×0.200=4 L。则a=100 L×![]() =3.5 L,此时b为最大值:13b=200-3.5×10=165 L。曲线的起点为(3.5,165),曲线的终点为(20,0)。该曲线为直线,由起点和终点即可作图。
=3.5 L,此时b为最大值:13b=200-3.5×10=165 L。曲线的起点为(3.5,165),曲线的终点为(20,0)。该曲线为直线,由起点和终点即可作图。
答案:(1)308 (2)52
(3)0.0923
(4)①13b=200-10a
②



科目:高中化学 来源: 题型:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 2.01 | 7.11 |
| 万全沉淀的pH | 4.77 | 3.68 | 9.61 |
查看答案和解析>>
科目:高中化学 来源: 题型:

设空气中N2、O2的含量分别为0.800和0.200(体积分数,以下气体含量均用体积分数表示),试完成下列各题:
(1)1.00 mol FeS2完全氧化,需要空气的体积(标准状况)为 L。
(2)55 L空气和足量FeS2完全反应后,气体体积(同温同压)变为 L。
(3)用空气氧化FeS2产生的气体混合物中,O2的含量为0.0800,计算SO2的含量。
(4)设FeS2氧化产生的气体混合物为100 L,其中O2为a L,SO2为b L。
①写出a和b的关系式。
②在图中画出a和b的关系曲线(氧化FeS2时,空气过量20%)。
说明:为方便作图,纵坐标用13b表示。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)1.00 mol FeS2被完全氧化,需要空气的体积(标准状况)为________L。
(2)
(3)用空气氧化FeS2产生的气体混合物中,O2的含量为0.080 0,计算SO2的含量。
(4)设氧化FeS2产生的气体混合物为
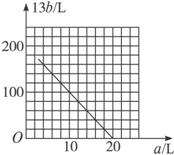
说明:为方便作图,纵坐标用13 b表示。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)1.00 mol FeS2被完全氧化,需要空气的体积(标准状况)为_________L。
(2)55 L空气和足量FeS2完全反应后,气体体积(同温同压)变为__________L。
(3)用空气氧化FeS2产生的气体混合物中,O2的含量为0.0800,计算SO2的含量。
(4)设氧化FeS2产生的气体混合物为100 L,其中O2为a L,SO2为b L。①写出a和b的关系式。②在下图中画出a和b的关系曲线(氧化FeS2时,空气过量20%)。
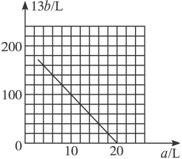
说明:为方便作图,纵坐标用13b表示。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com