
| A. | 氨燃料电池在放电时,氨气被氧化 | |
| B. | 氨燃料电池在放电时,正极反应为:2NH3+6e-+6OH-=N2+6H2O | |
| C. | 以氨气代替氢气的主要原因是:氨气易液化易储存 | |
| D. | 氨燃料电池产物为无污染的氮气和水,属于环境友好电池 |
分析 A、根据电池反应:4NH3+3O2=2N2+6H2O得到氨气是还原剂,被氧化;
B、氨燃料电池在放电时,负极上氨气失电子,正极上是氧气得电子的还原反应;
C、氨气比氢气易液化,易储存;
D、燃料电池的能量转化率较高,根据产物对环境的影响知识来回答.
解答 解:A、根据电池反应:4NH3+3O2=2N2+6H2O得到氨气是还原剂,被氧化,故A正确;
B、氨燃料电池在放电时,负极上氨气失电子生成N2,则负极反应为:2NH3-6e-+6OH-═N2+6H2O,正极上是氧气得电子的还原反应,故B错误;
C、氨气比氢气易液化,易储存,更适合大量使用,所以以氨气代替氢气,故C正确;
D、燃料电池的能量转化率比普通的电池高,产物为无污染的氮气和水,属于环境友好电池,故D正确.
故选B.
点评 本题考查原电池的组成以及工作原理,题目难度不大,注意燃料电池中正负极的判断及电极反应式的书写方法.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:实验题
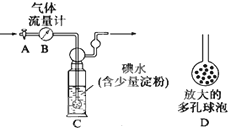 硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图甲中的每个小黑点表示1个电子 | |
| B. | 图乙表示1s电子只能在球体内出现 | |
| C. | 图乙表明1s轨道呈球形,有无数对称轴 | |
| D. | 不同能层的s轨道平均半径都一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
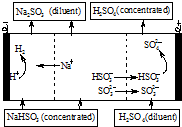 用NaOH溶液吸收SO2,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴阳膜组合循环再生机理如图,则下列说法不正确的是( )
用NaOH溶液吸收SO2,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴阳膜组合循环再生机理如图,则下列说法不正确的是( )| A. | 阳极区酸性增强 | |
| B. | diluent和concentrated的中文含义为浓缩的、稀释的 | |
| C. | 阴极区连接的是阳离子交换膜 | |
| D. | 该过程中的副产品主要为H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  图所示的反应为放热反应 | |
| B. | 化学反应中有物质变化也有能量变化 | |
| C. | 需要加热的化学反应不一定是吸热反应 | |
| D. | 化学键断裂吸收能量,化学键生成放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | Na2CO3 | NaHCO3 | Na2SiO3 | Na2SO3 | NaHSO3 | NaClO |
| pH | 11.6 | 9.7 | 12.3 | 10.0 | 4.0 | 10.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
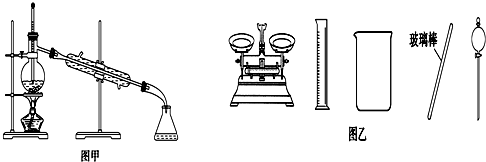
| A. | 可用碱式滴定管量取12.85 mL KMnO4溶液 | |
| B. | 实验室蒸馏石油可用如图甲所示实验装置 | |
| C. | 取用金属钠或钾时,没用完的钠或钾要放回原瓶 | |
| D. | 配制500 mL 0.4 mol•L-1 NaCl溶液,必要的仪器如图乙所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
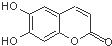 中草药秦皮中含有的七叶树内酯,具有抗菌作用.若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
中草药秦皮中含有的七叶树内酯,具有抗菌作用.若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )| A. | 2 mol Br2 2 mol NaOH | B. | 2 mol Br2 3 mol NaOH | ||
| C. | 3 mol Br2 4 mol NaOH | D. | 4 mol Br2 4 mol NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com