

 的酸性废水,可利用微生物电池法除去,其原理如图2所示
的酸性废水,可利用微生物电池法除去,其原理如图2所示| C2(CO2)?C(N2) |
| C2(NO)?C2(CO) |
| 0.022×0.01 |
| 0.182×0.082 |
| 0.022×0.07 |
| 0.182×0.142 |
 -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-,故答案为:Cl-
-OH+Cl-,故答案为:Cl- -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-;
-OH+Cl-; -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-,A极区溶液体积为1L,pH从4变到1,故△n(H+)=0.1mol,则知A极得0.2mol电子,
-OH+Cl-,A极区溶液体积为1L,pH从4变到1,故△n(H+)=0.1mol,则知A极得0.2mol电子,| 0.2 |
| 8 |
| 0.2 |
| 8 |


科目:高中化学 来源: 题型:
| A、比较多电子原子中电子能量大小的依据是电子离原子核的远近 |
| B、各能级最多容纳的电子数是该能级原子轨道数的二倍,其理论依据是构造原理 |
| C、电子排布在同一能级时,总是自由配对,优先占据同一轨道,且自旋方向相反 |
| D、钠的焰色与原子核外电子发生跃迁有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
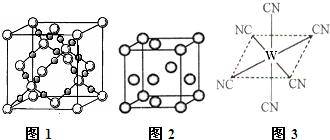
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
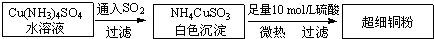
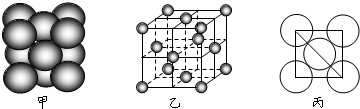
查看答案和解析>>
科目:高中化学 来源: 题型:
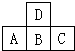 如图中A、B、C、D是短周期中同周期或同主族的相邻元素.
如图中A、B、C、D是短周期中同周期或同主族的相邻元素.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com