
科目:高中化学 来源:2016届浙江省高三上学期第三次月考化学试卷(解析版) 题型:填空题
“2015.8.12”天津港爆炸中有一定量的氰化物泄露。氰化物多数易溶于水,有剧毒,易造成水污染。已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 ( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
(1)根据价键规则,写出HCN的结构式是 ;
(2)下列能用于判断氮、碳两种元素非金属性强弱的是________。(填序号)
a.气态氢化物沸点
b.最高价氧化物对应水化物酸性强弱
c.Al2O3 + N2 + 3C == 2AlN + 3CO
d.单质晶体类型
(3)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是 ;通过列式计算“c(CN-)与c(HCN)”的大小 判断:c(CN-) c(HCN)(填“>”、“<”或“=”)
(4)含CN﹣的污水危害很大,处理该污水时,可在催化剂TiO2作用下用NaClO将CN﹣氧化成CNO﹣。CNO﹣在酸性条件下继续被NaClO氧化生成N2与CO2.某环保部门用下图装置进行实验,以证明该处理方法的有效性并测定CN﹣被处理的百分率。

将浓缩后含CN﹣的废水与过量NaClO溶液的混合液(其中CN﹣浓度为0.05mol/L)200mL倒入甲中,塞上橡皮塞,一段时间后,打开活塞,使溶液全部放入乙中,关闭活塞。
①甲中反应的离子方程式为 ;乙中反应的离子方程式为 。
②乙中生成的气体除CO2、N2外还有HCl及副反应生成的Cl2等,上述实验是通过测定CO2的量来确定CN﹣的处理效果.丙中加入的除杂试剂是 (填标号)。
(A)饱和食盐 (B)饱和NaHCO3溶液 (C)浓NaOH溶液 (D)浓硫酸
丁在实验中的作用是 。戊中盛有足量的石灰水,若实验后戊中共生成0.8g沉淀,则该实验中CN﹣被处理的百分率 80%(填“>”、“二”或“<”=)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上学期期中考试化学试卷(解析版) 题型:选择题
已知下列热化学方程式:
① Fe2O3(s) + 3CO(g) = 2Fe(s) + 3CO2(g) △H= -25kJ·mol-1
② 3Fe2O3(s) + CO(g) = 2Fe3O4(s) + CO2(g) △H= - 47kJ·mol-1
则下列关于Fe3O4(s)被CO还原成Fe(s)和CO2的热化学方程式的书写中正确的是( )
A.Fe3O4 + 4CO = 3Fe + 4CO2 △H= -14kJ·mol-1
B.Fe3O4(s) + 4CO(g) = 3Fe(s) + 4CO2(g) △H= -22kJ·mol-1
C.Fe3O4(s) + 4CO(g) = 3Fe(s) + 4CO2(g) △H= +14kJ·mol-1
D.Fe3O4(s) + 4CO(g) = 3Fe(s) + 4CO2(g) △H= -14kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016届安徽省皖江名校高三上学期12月联考化学试卷(解析版) 题型:选择题
已知以下反应可用于去除大气中的污染:NO2+NH3 +O2—一N2+H2O(未配平)。若NO2、NH3、
O2三者恰好反应,则体积比可能是
A.2:4:1 B.2:1:2 C.l:1:1 D.l:4:3
查看答案和解析>>
科目:高中化学 来源:2016届安徽省皖江名校高三上学期12月联考化学试卷(解析版) 题型:选择题
运用有关概念判断下列说法正确的是
A.NH4Cl中有离子键,是离子化合物
B.46g C2H5OH燃烧放出的热量为乙醇的燃烧热
C. 互为同系物
互为同系物
D.绿色化学的核心是应用化学原理对环境污染进行治理
查看答案和解析>>
科目:高中化学 来源:2016届河北省张家口市四校高三上学期联考化学试卷(解析版) 题型:选择题
1 mol某烃在氧气中充分燃烧,需要消耗氧气246.4 L(标准状况下)。它在光照的条件下与氯气反应能生成四种不同的一氯取代物。该烃的结构简式是
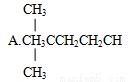
B.CH3CH2CH2CH2CH3
C.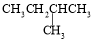
D.
查看答案和解析>>
科目:高中化学 来源:2016届湖北省八校高三上学期12月联考理综化学试卷(解析版) 题型:填空题
【化学——选修2:化学与技术】
工业上以Al(OH)3、H2SO4、(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如图所示:
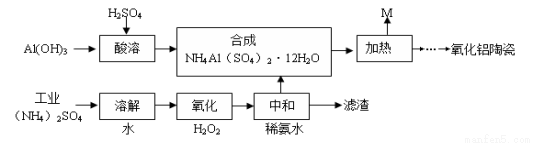
回答下列问题:
(1)氧化步骤中发生的主要反应的离子方程式为 。
(2)已知:25℃时,KW=1.0×10-14,Kb(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:
NH4++H2O NH3·H2O+H+,则该反应的平衡常数为 。
NH3·H2O+H+,则该反应的平衡常数为 。
(3)NH4Al(SO4)2溶液与过量NaOH溶液混合加热,反应的化学方程式为 。
(4)固体NH4Al(SO4)2·12H2O在加热时,固体残留率随温度的变化如图所示。633℃时剩余固体的成分为 。
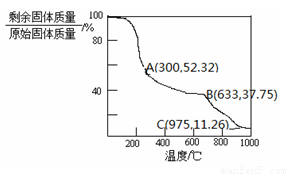
(5)综上分析,流程图中M混合气体的主要成分的化学式为 。M可用一种物质吸收以实现循环利用,该物质的名称是 。
查看答案和解析>>
科目:高中化学 来源:2016届天津市等六校高三上学期期中联考化学试卷(解析版) 题型:填空题
某无色溶液的溶质只由以下离子中的若干离子构成:Na+、Ag+、Ba2+、Al3+、AlO2﹣、CO32﹣、SO42﹣.将该溶液进行如下实验,根据所给实验现象判断原溶液中离子的存在情况,填写空格.
(1)取适量该溶液,加入过量盐酸,有气体生成,最终得到无色透明溶液.肯定存在的离子 ;肯定不存在的离子 .
(2)在(1)所得到的溶液中再加入过量NH4HCO3溶液,有无色无味的气体生成,同时析出白色沉淀.原溶液中肯定存在的离子 ,写出生成沉淀的离子方程式 .
(3)在(2)所得溶液中加入过量Ba(OH)2溶液,加热,有刺激性气味的气体生成,同时析出白色沉淀.沉淀中一定含有
(4)原溶液中溶质的成分为 (填写化学式)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上学期期中(理)化学试卷(解析版) 题型:选择题
元素电负性随原子序数的递增而增强的是
A.Li、Na、K B.N、P、As C.O、S、Se D.Si、P、Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com