
| A. | 可逆反应达到化学平衡状态时,正、逆反应速率均等于零 | |
| B. | 当反应物与生成物浓度相等时,可逆反应一定已达到化学平衡状态 | |
| C. | 用锌粉代替锌粒与等浓度的稀硫酸反应,生成氢气的速率加快 | |
| D. | Fe与稀硫酸反应制取氢气时,改用浓硫酸可以增大反应速率 |
分析 化学平衡状态是指正逆反应速率相等、各组分浓度保持不变的状态,影响化学反应速率的因素有温度、浓度、压强、催化剂和接触面积等等,据此分析.
解答 解:A、可逆反应达到化学平衡状态时,正逆反应速率相等但不等于零,故A错误;
B、化学平衡状态是各组分浓度不变的状态,不一定相等,故B错误;
C、用锌粉代替锌粒与等浓度的稀硫酸反应,增大了固体Zn与硫酸的接触面积,反应速率加快,故C正确;
D、Fe在浓硫酸中钝化,不能生成氢气,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断和化学反应速率的影响,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意相关基础知识的学习和积累,难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:解答题
| 第一电离能 | 电负性 | 晶格能 | 沸点 |
| O<N | Cl<F | NaCl<CaO | HF>HCl |
| 共价键 | H-Cl | O=O | H-O | Cl-Cl |
| 键能/kJ•mol-1 | 431 | 498 | 463 | 243 |
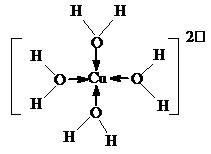 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 转化率(%) | 0.1MPa | 0.5MPa | 1.0MPa | 10MPa |
| 400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
| 500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
| 600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能与碳酸钠反应产生气体 | B. | 能被酸性高锰酸钾氧化 | ||
| C. | 能发生酯化反应 | D. | 能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
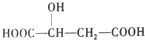 ,下列说法错误的是( )
,下列说法错误的是( )| A. | 1mol苹果酸可与2 molNaOH发生中和反应 | |
| B. | -定条件下,苹果酸与乙酸或乙醇均能发生酯化反应 | |
| C. |  与苹果酸互为同分异构体 与苹果酸互为同分异构体 | |
| D. | 1mol苹果酸与足量金属Na反应生成1.5 molH 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
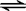 CH3COOH+OH-;
CH3COOH+OH-;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小.
某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小. ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA溶液的导电性较弱,则HA为弱酸 | |
| B. | S02的水溶液能导电,则S02为电解质 | |
| C. | HC1在水中能完全电离,则盐酸为强电解质 | |
| D. | BaS04是电解质,但其水溶液不导电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com