
| A、19.6% | B、17.8% |
| C、16% | D、14.2% |
| 8 |
| 9 |
| 1 |
| 6 |
| 8 |
| 9 |
| 8 |
| 9 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、常温下,1L 0.1 mol/L的NH4NO3溶液中氮原子数为0.2NA |
| B、1mol羟基中电子数为10NA |
| C、等物质的量的O2和CO所含分子数均为NA |
| D、常温常压下,22.4L乙烯中C-H键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、氨水加水稀释,
| ||||
| B、若酸性HA>HB,则含等物质的量的NaA和NaB的混合溶液中有c(OH-)>c(A-)>c(B-)>c(H+) | ||||
C、在含等物质的量的碳酸氢钠和碳酸钠的混合溶液中有3c(Na+)=2c(HC
| ||||
| D、25℃时,向一定量的醋酸溶液中逐滴加入氢氧化钠溶液,溶液的pH不会小于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol 氯气与足量氢氧化钠溶液完全反应,转移电子数目为2NA |
| B、14g氮气中含有14 NA个原子 |
| C、1L1.00 mol/L的Na2SO4溶液中Na+离子数目为2NA |
| D、11.2 L氢气中含有NA个氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
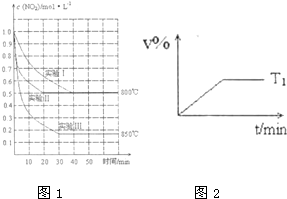 体积为2L的密闭容器中反应2NO2(g)?2NO(g)+O2(g)在三种不同条件下进行,其中实验I、II都在800℃、实验III在850℃;NO、O2的起始浓度都为0,NO2 的浓度随时间的变化如图所示.请回答下列问题:
体积为2L的密闭容器中反应2NO2(g)?2NO(g)+O2(g)在三种不同条件下进行,其中实验I、II都在800℃、实验III在850℃;NO、O2的起始浓度都为0,NO2 的浓度随时间的变化如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| 弱酸 | HClO2 | HF | HCN | H2S |
| Ka/mol?L-1 | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||||
B、Ag+、H+
| ||||
| C、NH4+、Br-、Na+、SO42- | ||||
D、H+、CI-、Fe2+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )
如图所示是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )| A、该硫酸的物质的量浓度为9.2mol/L |
| B、常温下将1mol铁加入足量该硫酸中可产生2gH2 |
| C、该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2mol/L |
| D、配制250mL4.6mol/L的H2SO4溶液需取该硫酸62.5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com