
Ⅰ.已知某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其它物质.

(1)步骤1的主要操作是________,需用到的玻璃仪器除烧杯外有________.
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式)________.
(3)步骤2中在分离Hg和固体残渣时,在封闭体系中加热、冷凝回收的方法,原因是________
(4)步骤3之后在B中加入液体混合物X(稀H2SO4和一种绿色氧化剂),仅生成硫酸铜溶液,无其它物质生成,反应方程式是________.
(5)步骤4中涉及的操作是:蒸发浓缩、________、过滤、烘干.
Ⅱ.在CuSO4溶液中加入适量KI溶液,有白色沉淀CuI生成,写出反应的离子方程式________.
现以下列电解池装置电解KI溶液:

请回答:电解开始不久时,电解池中的现象是________.
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 6.830 | 13.660 | 30.000 |
| 二氧化硫气体的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.800 | 1.600 | 3.200 |
查看答案和解析>>
科目:高中化学 来源: 题型:
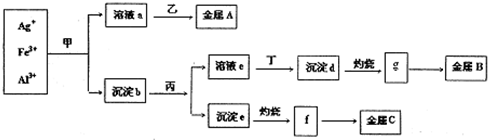
| A、金属A、B、C分别为Ag、Fe、Al | B、g、f都为氧化物,工业上均采用电解g与f获得对应金属单质 | C、沉淀b为混合物,主要成分为沉淀d和沉淀e | D、甲是氢氧化钠,丁为稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
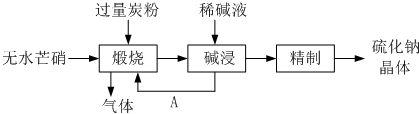
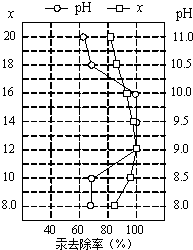 (4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图所示).为使除汞效果最佳,应控制的条件是
(4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图所示).为使除汞效果最佳,应控制的条件是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com