
| A、3.4mol/L |
| B、0.2mol/L |
| C、1.8mol/L |
| D、3.6mol/L |
| n |
| V |
| 2.24L |
| 22.4L/mol |
| 2.016L |
| 22.4L/mol |
| 0.01mol×2 |
| 1 |
| 0.34mol |
| 0.1L |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:用试管取样品溶液2~3mL,再用滴管取 | 若出现血红色,则假设1成立; 若未出现血红色,则假设2或假设3成立. |
| 步骤2: | 结合步骤1的现象和结论, |
查看答案和解析>>
科目:高中化学 来源: 题型:

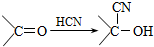

 ):
):
查看答案和解析>>
科目:高中化学 来源: 题型:
 化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题:
化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液、萃取、蒸馏 |
| B、萃取、蒸馏、分液 |
| C、分液、蒸馏、蒸发 |
| D、蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是( )
将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是( )| A、原合金质量为0.92g |
| B、标准状况下产生氢气896mL |
| C、图中V2为60mL |
| D、图中m值为1.56g |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定条件下,将一定量的A、B、C、D四种物质,置于密闭容器中发生如下反应:mA(s)+nB(g)?pC(g)+q(D)g.达到平衡后,测得B的浓度为0.5mol/L.保持温度不变,将密闭容器的容积扩大到原来的两倍,再次达到平衡后,测得B的浓度为0.2mol/L.当其条件不变时,C在反应混合物中的体积分数(x)与温度(T)、时间(t)的关系如图所示,下列叙述正确的是( )
一定条件下,将一定量的A、B、C、D四种物质,置于密闭容器中发生如下反应:mA(s)+nB(g)?pC(g)+q(D)g.达到平衡后,测得B的浓度为0.5mol/L.保持温度不变,将密闭容器的容积扩大到原来的两倍,再次达到平衡后,测得B的浓度为0.2mol/L.当其条件不变时,C在反应混合物中的体积分数(x)与温度(T)、时间(t)的关系如图所示,下列叙述正确的是( )| A、容积扩大到原来的两倍,平衡向逆反应方向移动 |
| B、化学方程式中n>p+q |
| C、达到平衡后,若升高温度,平衡向逆反应方向移动 |
| D、达到平衡后,增加A的量,有利于提高B的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 原子序数依次增大的X、Y、Z、M、N五种元素,XZ2是引起温室效应的主要气体,M
原子序数依次增大的X、Y、Z、M、N五种元素,XZ2是引起温室效应的主要气体,M查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com