
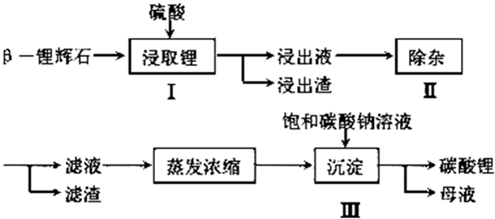
分析 已知β-锂辉石(主要成分为Li2O•Al2O3•4SiO2)为原材料制备Li2CO3的工艺流程:Li2O•Al2O3•4SiO2加硫酸,浸取,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,在在搅拌下加入石灰石调节pH,使Al3+、Fe3+转化为氢氧化物沉淀,过滤,再将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,Fe2+被氧化为Fe3+,然后转化为氢氧化铁沉淀,镁离子转化为氢氧化镁沉淀,钙离子转化为碳酸钙沉淀,过滤的硫酸锂溶液,再加饱和碳酸钠溶液得到碳酸锂沉淀,过滤得到碳酸锂,以此解答该题.
解答 解:(1)结合题干所给信息可知,调节溶液的pH到6.0~6.5时,Fe3+、Al3+已完全沉淀,对应生成的产物为Fe(OH)3、Al(OH)3,故答案为:Fe3+、Al3+;
(2)H2O2在酸性条件下可以将Fe2+氧化为Fe3+,再调节pH将Fe3+转化为Fe(OH)3沉淀而除去.所以,离子反应式为Fe2++2H++2H2O2=2Fe3++2H2O;通过加入H2O2溶液、石灰乳和Na2CO3溶液,剩余的Ca2+转化为CaCO3,而杂质Mg2+则转化为比微溶物MgCO3更难溶解的Mg(OH)2.所以,步骤Ⅱ所得滤渣主要成分是Fe(OH)3、CaCO3、Mg(OH)2,
故答案为:Fe2++2H++2H2O2=2Fe3++2H2O;Fe(OH)3、CaCO3、Mg(OH)2;
(3)将NaOH杂质转化为Na2SO4,可以向母液中加入适量的H2SO4;而为了得到带结晶水的Na2SO4,可以将溶液蒸发浓缩,冷却结晶,
故答案为:硫酸(或稀硫酸、浓硫酸);蒸发浓缩;冷却结晶.
点评 本题考查了物质分离提纯实验操作,为高考常见题型,考查考生运用金属元素的有关知识分析解决问题的能力,涉及离子共存、离子方程式、氧化还原反应、物质的鉴别与分离等,题目难度中等,以实验探究的形式考查元素化合物的性质将成为以后高考命题的新亮点.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:推断题
 ,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑.
,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
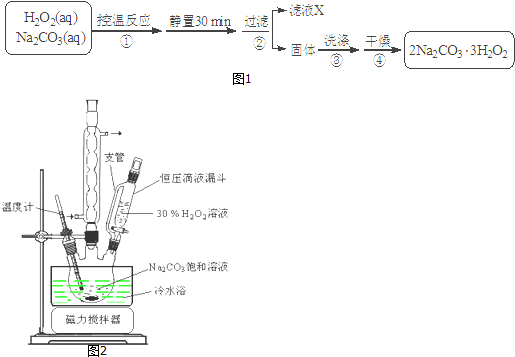
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
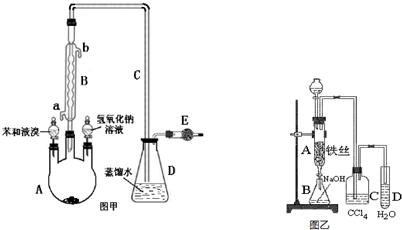
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
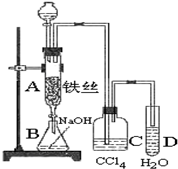 实验室用图装置制取少量溴苯,试填写下列空白.
实验室用图装置制取少量溴苯,试填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 11种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
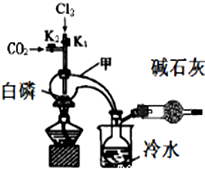 三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 白磷 | 44.1 | 280.5 | 1.82 |
| PCl3 | -112 | 75.5 | 1.574 |
| POCl3 | 2 | 105.3 | 1.675 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
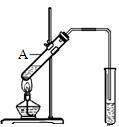 乙酸是食醋的主要成分,它具有以下化学性质:
乙酸是食醋的主要成分,它具有以下化学性质:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com