
| A. | 过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离有机混合物的方法 | |
| B. | 洗涤胶头滴管时,只要在水龙头的流水中,滴头朝上,胶头朝下不断挤压胶头即可 | |
| C. | 通常采用产生气泡的快慢,来比较不同条件下Na2S2O3溶液与稀硫酸的反应速率 | |
| D. | 吸入氯气、氯化氢气体时,可吸入少量酒精或乙醚的混合蒸气解毒 |
分析 A.有机物一般不用过滤的方法分离;
B.滴头朝上,胶头朝下易腐蚀胶头;
C.Na2S2O3溶液与稀硫酸反应不生成气体;
D.酒精和乙醚具有麻醉作用,减弱对呼吸道的刺激,减轻咳嗽.
解答 解:A.过滤是分离固体与液体的方法,一般用于分离无机物,故A错误;
B.滴头朝上,胶头朝下易腐蚀胶头,故B错误;
C.因二氧化硫易溶于水,Na2S2O3溶液与稀硫酸反应不生成气体,故C错误;
D.酒精和乙醚具有麻醉作用,减弱对呼吸道的刺激,减轻咳嗽,则实验室中吸入氯气、氯化氢气体时,可吸入少量酒精或乙醚的混合蒸气解毒,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的特性为解答的关键,侧重物质性质及混合物分离提纯的考查,注意实验操作的可行性评价,题目难度较大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.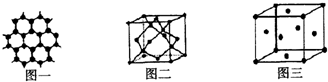
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 伏打电堆(Voltaic pile)的照片和结构如图.它用圆形的锌板、铜板间隔堆积而成.所有的圆板之间夹放几层盐水泡过的布.下列说法正确的是( )
伏打电堆(Voltaic pile)的照片和结构如图.它用圆形的锌板、铜板间隔堆积而成.所有的圆板之间夹放几层盐水泡过的布.下列说法正确的是( )| A. | 伏打电堆能将电能转化成化学能 | B. | 锌是正极 | ||
| C. | 盐水是电解质溶液 | D. | 伏打电堆工作时铜被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
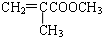 )是生产有机玻璃的单体.
)是生产有机玻璃的单体. .
. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$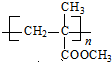 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
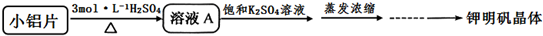
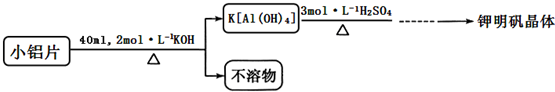
| 温度(℃) 物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| K2SO4 | 7.4 | 9.2 | 11.1 | 12.97 | 14.8 | 16.6 | 18.17 | 19.8 | 21.4 | 22.4 | 24.1 |
| Al2(SO4)3•18H2O | 31.2 | 33.5 | 36.4 | 40.4 | 45.7 | 52.2 | 59.2 | 66.2 | 73.1 | 86.8 | 89.0 |
| KAl(SO4)2•12H2O | 3.0 | 4.0 | 5.9 | 8.4 | 11.7 | 17.0 | 24.8 | 40.0 | 71.0 | 109.0 | 154.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
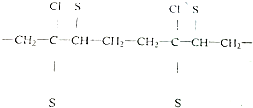
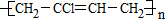 _.
_.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知K=$\frac{{c}^{2}C{O}_{2}•{c}^{6}•{H}_{2}}{{c}^{3}{H}_{2}O•cC{H}_{3}C{H}_{2}OH}$,则对应的化学反应可以表示为2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g) | |
| B. | 将某浓度氢氟酸溶液升高温度,氢氟酸的电离度(α)和电离平衡常数Ka都变大 | |
| C. | 常温下,向纯水中加入碳酸钠,水的电离程度变大,KW变大 | |
| D. | 化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小,或者不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
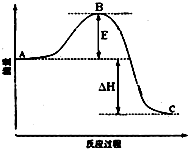 安徽金和上市公司近期新增硫酸生产线.其主要反应 为:2SO2(g)+O2(g)═2SO3(g),该反应过程的能量变化如图所示.
安徽金和上市公司近期新增硫酸生产线.其主要反应 为:2SO2(g)+O2(g)═2SO3(g),该反应过程的能量变化如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com