
【题目】目前,人们对环境保护、新能源开发很重视。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,能使有毒气体转化为无毒气体:4CO(g)+2N02(g)![]() C02(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是_____填字母);
C02(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是_____填字母);
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C. 2v逆(NO2)=v正(N2)
D.容器内混合气体密度保持不变
(2)用活性炭还原法也可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g)△H。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g)△H。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
浓度/mol·L-1 | ||||||
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析Tl℃时,该反应在0~20 min的平均反应速率v(C02)=___;计算该反应的平衡常数K=____。(保留两位有效数字)
②根据上表数据判断,由30 min到40 min时改变的条件可能是(任写一种)_____。
(3)以CO2span>与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
③H2O(l)=H2O(g)△H=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式____。
(4)科学家利用原电池原理,在酸性溶液中将N02转化为HN03,则该转化的负极电极方程式为____。
【答案】A B 0.015 mol·L-1·min-10.56通入一定量NO(或适当缩小容器体积或充入一定量1∶1的氮气和二氧化碳)2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)ΔH=–87.0 kJ·mol-1NO2-e-+H2O=NO3-+2H+
【解析】
(1)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。则
A.容器内混合气体颜色不再变化说明NO2浓度不再发生变化,反应达到平衡状态,A正确;
B.正反应体积减小,则容器内的压强保持不变,说明反应达到平衡状态,B正确;
C. 2v逆(NO2)=v正(N2)时不满足反应速率之比是化学计量数之比,没有达到平衡状态,C错误;
D.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,容器内混合气体密度保持不变不能说明反应达到平衡状态,D错误。
答案选AB。
(2)①0~20min内,CO2的平均反应速率v(CO2)=0.3mol/L÷20min=0.015molL-1min-1;反应C(s)+2NO(g)![]() N2(g)+CO2(g)的平衡浓度c(N2)=0.3mol/L、c(CO2)=0.3mol/L、c(NO)=0.4mol/L,因此反应的平衡常数K=c(N2)×c(CO2)/c2(NO)=0.3×0.3/0.42=0.56;
N2(g)+CO2(g)的平衡浓度c(N2)=0.3mol/L、c(CO2)=0.3mol/L、c(NO)=0.4mol/L,因此反应的平衡常数K=c(N2)×c(CO2)/c2(NO)=0.3×0.3/0.42=0.56;
②30min后,只改变某一条件,反应重新达到平衡,依据图表数据分析,平衡状态物质浓度增大,依据平衡常数计算K=c(N2)×c(CO2)/c2(NO)=0.36×0.36/0.482=0.56,平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度增大,反应前后气体体积不变,所以改变的条件可能是通入一定量NO或适当缩小容器体积或充入一定量1∶1的氮气和二氧化碳;
(3)①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
③H2O(l)=H2O(g)△H=+44.0kJ/mol
依据热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式为2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)ΔH=–87.0 kJ·mol-1;
(4)利用原电池原理,在酸性溶液中将N02转化为HN03,负极发生失去电子的氧化反应,则该转化的负极电极方程式为NO2-e-+H2O=NO3-+2H+。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】有甲、乙两种物质:

(1)乙中含有的官能团的名称为__________________(不包括苯环)。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
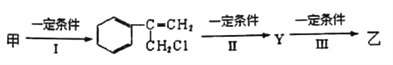
反应I的化学其中反应I的反应类型是____________________,反应II的条件是________,反应III的化学方程式为_________________(不需注明反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是一种强还原性的碱性液体,常用作火箭燃料。利用尿素法生产水合肼的原理为CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl。
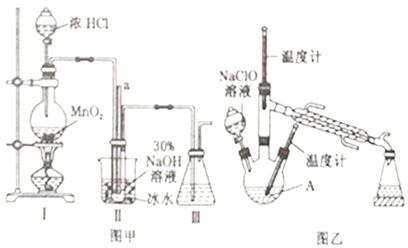
实验1:制备NaClO溶液(己知:3NaClO![]() 2NaCl+NaClO3)。
2NaCl+NaClO3)。
(1)图甲装置Ⅰ中烧瓶内发生反应的离子方程式为________________________。
(2)用NaOH固体配制溶质质量分数为30%的NaOH溶液时,所需玻璃仪器有_______________。
(3)图甲装置Ⅱ中用冰水浴控制温度的目的是________________________。
实验2:制取水合肼
(4)图乙中若分液漏斗滴液速度过快,部分N2H4·H2O会参与A 中反应并产生大量氮气,降低产品产率,该过程中反应生成氮气的化学方程式为__________________。充分反应后,蒸馏A中溶液即可得到水合肼的粗产品。
实验3:测定馏分中水合肼的含量
(5)称取馏分3.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH 保持在6.5 左右),加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加2~3 滴淀粉溶液。用0.15mol·L-1的碘的标准溶液滴定。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定操作中若不加入适量NaHCO3固体,则测量结果会___________“偏大”“ 偏小”“ 无影响”)。
②下列能导致馏分中水合肼的含量测定结果偏高的是___________(填字母)。
a.锥形瓶清洗干净后未干燥
b.滴定前,滴定管内无气泡,滴定后有气泡
c.读数时,滴定前平视,滴定后俯视
d.盛标准液的滴定管水洗后,直接装标准液
③实验测得消耗I2溶液的平均值为20.00mL,馏分中水合肼(N2H4·H2O)的质量分数为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌焙砂是锌精矿经焙烧后所得的产物,以锌焙砂为原料制取金属锌的流程如图所示。
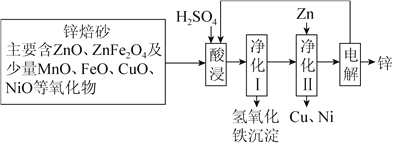
已知:①当溶液中Zn2+浓度较大时,Zn2+优先于H+放电。
②碱性条件下Mn(Ⅱ)可以被氧气氧化生成Mn(Ⅵ)。
请回答下列问题:
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为_____________________________。
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式:___________。
②25 ℃时,pH=3的滤液(滤去氢氧化铁沉淀)中,c(Fe3+)=________mol·L-1(已知25 ℃时,Ksp[Fe(OH)3]=4.0×10-38)。
(3)电解硫酸锌溶液时阳极上有气体析出,写出阳极的电极反应式_____________________________;
电解时不断补充电解液的目的是_________________________。
(4)电解时,阳极附近发生化学反应生成HMnO4,使得溶液变为紫红色,生成的HMnO4,又将Mn2+氧化生成MnO2,一部分二氧化锰沉于槽底形成阳极泥,另一部分附于阳极表面形成保护膜。写出HMnO4将Mn2+氧化生成MnO2的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是
①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水
A. ①② B. ①③ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按右下图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)( )

A. C1上发生还原反应
B. M 装置中SO42-移向Cu电极
C. 工作一段时间后装置M 中溶液pH变小,装置N中溶液pH变大
D. Cu电极与C2电极上的电极反应相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的数值,下列叙述中正确的是( )
A. 物质的量就是指物质的多少
B. 24g金属镁变为镁离子时失去的电子数为NA
C. 常温常压下,48g O3含有的氧原子数为3NA
D. 同温同压下,NA个NO与NA个N2和O2的混合气体的体积不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C分别代表中学化学中常见物质,请根据题目要求回答下列问题:
(1)实验室常用A的饱和溶液制备微粒直径为lnm-100nm的红褐色液相分散系,则该反应的化学方程式为:_____,将A的溶液加热蒸干并灼烧,得到固体的化学式为:_____。
(2)B为地壳中含量最高的金属元素的氯化物,向50.0mL,6mol/L的B溶液中逐滴滴入100mL某浓度的KOH溶液,若产生7.8g白色沉淀,则加入的KOH溶液的浓度可能为____。
(3)将A、B中两种金属元素的单质用导线连接,插入一个盛有KOH溶液的烧杯中构成原电池,则负极发生的电极反应为:_______。
(4)C是常见温室气体,将一定量的气体C通入100mL 某浓度的KOH得溶液F,向F溶液中逐滴加入2 molL-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。则F溶质与足量石灰水发生反应最多可得沉淀的质量为____g。
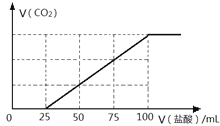
(5)pH = 3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液。若溶液的pH偏高,则碱式硫酸铝产率降低且有气体C产生,用化学方程式表示其原因_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com