
| A、加入合金的质量不可能为6.4 g |
| B、参加反应的硝酸的物质的量为0.1 mol |
| C、沉淀完全时消耗NaOH溶液的体积为150 mL |
| D、溶解合金时收集到NO气体标准状况下的体积为2.24 L |
| 5.1g |
| 17g/mol |
| 8 |
| 3 |
| n |
| c |
| 5.1g |
| 17g/mol |
| 1 |
| 2 |
| 0.3mol |
| 2 |
| 8 |
| 3 |
| 8 |
| 3 |
| 0.3mol |
| 3mol/L |
| 0.3mol |
| 5-2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定含有甲烷 |
| B、可能有乙烯 |
| C、一定含有乙烷,不一定含有甲烷 |
| D、一定不含有乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下,pH为11的氨水与pH为3的盐酸等体积混合,溶液呈中性 |
| B、在0.1 mol/L(NH4)2Fe(SO4)2溶液中:c(H+)+c(NH4+)+c(Fe2+)═c(OH-)+c(SO42-) |
| C、向醋酸溶液中加入适量醋酸钠,所得酸性溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、0.2mo1?L-1的Na2CO3溶液:c(OH-)═c(HCO3-)+c(H+)+2c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| A、所涉及元素中原子半径:C>N>O |
| B、等物质的量N2和CO2中,共价键的个数比为3:4 |
| C、氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
| D、当x=2时,每生成1mol N2,转移电子数为4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
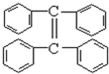 烯烃分子在一定条件下会发生二分子聚合,其实质是一个分子中饱和碳原子上的一个C-H键断裂,对另一个分子中的双键进行加成.也可以烯烃复分解反应.如:
烯烃分子在一定条件下会发生二分子聚合,其实质是一个分子中饱和碳原子上的一个C-H键断裂,对另一个分子中的双键进行加成.也可以烯烃复分解反应.如:
| 金属卡宾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
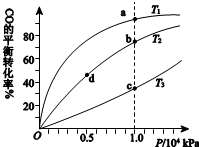 用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右下图所示.下列说法正确的是( )
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右下图所示.下列说法正确的是( ) | A.温度: | T1>T2>T3 | |
| B.正反应速率: | υ(b)>υ(d) | υ(a)>υ(c) |
| C.平衡常数: | K(a)>K(c) | K(b)=K(d) |
| D.平均摩尔质量: | M(b)>M(d) | M(a)<M(c) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
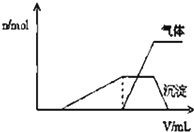 1L某混合溶液中可能含有的离子如下表:
1L某混合溶液中可能含有的离子如下表:| 可能大量含有的阳离子 | H+NH4+Al3+K+ |
| 可能大量含有的阴离子 | Cl-Br-I?ClO?AlO2- |
| Cl2的体积 (标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com