
【题目】运用元素周期表分析下列判断,其中错误的是( )
A.铍(Be)的氧化物的水合物可能是两性氧化物
B.硒化氢(![]() )是有色、有毒的气体,比
)是有色、有毒的气体,比![]() 稳定
稳定
C.![]() 的酸性比
的酸性比![]() 的酸性弱
的酸性弱
D.砹(At)为有色固体,HAt不稳定,AgAt感光性强,不溶于一般的酸
【答案】B
【解析】
A. 元素周期表中Be和Al处于对角线位置上,处于对角线的元素具有相似性,BeO、Be(OH)2均有两性,故A正确,不符合题意;
B. 同主族元素的原子,从上到下氢化物的稳定性逐渐减弱,所以硒化氢(H2Se)不如H2S稳定,故B错误,符合题意;
C.硫元素与硒元素是同一主族元素,从上到下非金属性逐渐减弱,最高价氧化物的水化物的酸性逐渐减弱,故C正确,不符合题意;
D. 卤族元素性质具有相似性,根据碘单质的性质可推断At为有色物质,AgI不溶于水也不溶于稀酸,AgAt难溶于水也不溶于稀硝酸,但同主族元素的原子,从上到下氢化物的稳定性逐渐减弱,所以HAt不如HI稳定,故D正确,不符合题意;
故选:B。


科目:高中化学 来源: 题型:
【题目】七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上有重要的用途。硼镁泥是硼镁矿生产硼砂的废渣,其主要成分是MgCO3,还含有MgO、CaO、Fe2O3、FeO、MnO2、Al2O3、SiO2等杂质,工业上用硼镁泥制取七水硫酸镁的工艺流程如图:
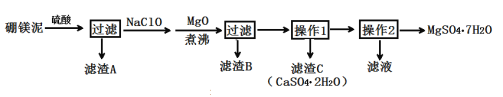
已知:①MnO2不溶于稀硫酸。
②CaSO4和MgSO4·7H2O在不同温度下的溶解度(g)数据如下表所示:
温度/℃ 物质 | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.21 | 0.19 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | —— |
(1)开始用到硫酸的质量分数为70%,密度为1.61g/cm3,则该硫酸溶液的物质的量浓度为___。
(2)滤渣A中除含少量CaSO4·2H2O外,还有___。
(3)加入MgO后,加热煮沸的目的是___。
(4)若滤渣B的主要成分为Al(OH)3和Fe(OH)3。则加入NaClO发生氧化还原反应的离子方程式为___。
(5)流程中操作1为蒸发浓缩、趁热过滤,这样即可得到CaSO4·2H2O,又防止___。
(6)获取MgSO4·7H2O的操作2为:___、___、过滤洗涤。
(7)已知开始硼镁泥样品的质量为ag,制取七水硫酸镁的质量为bg,据此能计算出硼镁泥中镁元素的含量吗?若能,请写出表达式;若不能,请说明理由。___(能或不能),表达式(或理由)为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。下列说法错误的是
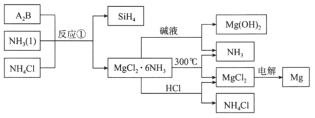
A.A2B的化学式为Mg2Si
B.该流程中可以循环使用的物质是NH3和NH4Cl
C.利用MgCl2·6NH3制取镁的过程中发生了化合反应、分解反应
D.分别将MgCl2溶液和Mg(OH)2悬浊液加热、灼烧,最终得到的固体相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储量丰富成本低的新型电池系统引起了科学家的广泛关注。基于K+能够可逆地嵌入/脱嵌石墨电极,开发了基于钾离子电解液(KPF6)的新型双碳电池[碳微球(C)为正极材料,膨胀石墨(C*y)为负极材料],放电时总反应为:KxC*y+xC(PF6)=C*y+xK++xC+xPF6-,如图所示。下列叙述错误的是( )
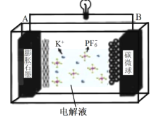
A.放电时,K+在电解质中由A极向B极迁移并嵌入碳微球中
B.充电时,A极的电极反应式为C*y+xK++xe-=KxC*y
C.放电时,每转移0.1NA电子时,电解质增重18.4g
D.充放电过程中,PF6-在碳微球电极上可逆地嵌入/脱嵌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84”消毒液、医用酒精等能对新冠病毒进行有效消杀。某兴趣小组在实验室自制“84”消毒液。请回答以下问题:
(1)“84”消毒液消杀新冠病毒的原理是__。
(2)甲同学设计图1所示实验装置(夹持装置省略)制取“84”消毒液。
①B中的试剂是__。
②干燥管的作用是__。
③当C中NaOH溶液吸收完全后,停止通氯气,检验氯气已过量的方法为__。
(3)乙同学设计图2所示电解装置制取“84”消毒液。
①铁电极作__极。
②该电解制取NaClO的总反应的化学方程式为__。
③充分电解后,为检验电解液中是否还残留少量Cl-,取少量电解后溶液于试管中,滴加AgNO3溶液,试管中产生白色沉淀并有无色气体产生,该气体能使带火星的木条复燃。试管中发生反应的离子方程式为___。
④取25.00mL电解后溶液,加入过量KI与稀硫酸混合溶液,充分反应后加入2滴淀粉液,用0.1000molL-1Na2S2O3溶液滴定,消耗12.00mL。则该电解液有效氯(以有效氯元素的质量计算)的浓度为___mg/L。(已知:2S2O32-+I2═S4O62-+2I-)
(4)与甲同学制法相比,乙同学制法的优点除了有装置与操作简单外还有:__、__(请列举出两种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
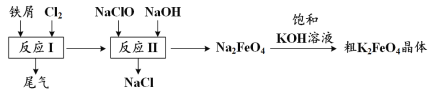
下列叙述不正确的是
A.用K2FeO4对饮用水杀菌消毒的同时,还产生Fe(OH)3胶体吸附杂质净化水
B.用FeCl2溶液吸收反应I中尾气后可再利用
C.反应II中氧化剂与还原剂的物质的量之比为3∶2
D.该生产条件下,物质的溶解性:Na2FeO4< K2FeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际能源期刊报道了一种正在开发中的绿色环保“全氢电池”,有望减少废旧电池产生污染。其工作原理如图所示。下列说法正确的是
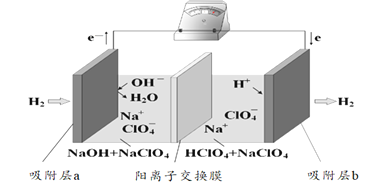
A.“全氢电池”工作时,将酸碱反应的中和能转化为电能
B.吸附层b发生的电极反应:H2 – 2e- + 2 OH-= 2H2O
C.Na+ 在装置中从右侧透过阳离子交换膜向左侧移动
D.“全氢电池”的总反应: 2H2 + O2 =2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
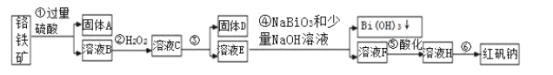
【题目】Ⅰ.某化工厂以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),工艺流程如图:
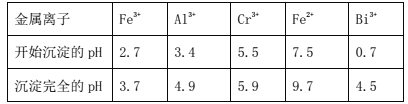
i.常温,NaBiO3不溶于水,有强氧化性,碱性条件下,能将Cr3+转化为CrO42-。
ii.常温时,部分金属离子开始沉淀和完全沉淀时的pH值
(1)步骤①提高酸溶速率的措施__(任填一条即可)。固体A的成分是___。
(2)步骤③需加氢氧化钠溶液调节pH,调节pH范围为__,目的是__。
(3)写出④反应的离子方程式__。
(4)将溶液H经过__即得红矾钠粗晶体。
Ⅱ.经该工厂的工业废水中含1.00×10-3mol·L-1的Cr2O72-,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),又设计了如下工艺流程:
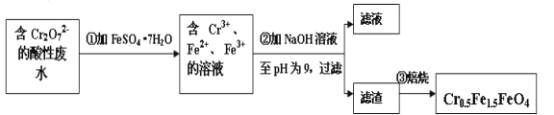
(5)第①步反应的离子方程式是__。
(6)常温时,如忽略步骤①所加FeSO4·7H2O所引起的溶液体积变化,依据上表数据,则步骤②加入NaOH溶液调节溶液的pH至9时,溶液中Cr3+的浓度为___mol/L(101/2≈3.2)。
(7)欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入FeSO4·7H2O的质量为__g(已知FeSO4·7H2O的摩尔质量为278g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值,下列说法中正确的是( )
A.标准状况下,22.4 L 甲苯所含的分子数约为NA
B.室温下,2.8g 乙烯与丙烯的混合物中含碳原子的数目为 0.2NA
C.1 mol C3H8 分子中含有共价键的数目为 9 NA
D.1 mol 氯气和足量甲烷在光照条件下反应可生成 2 NA 个氯化氢分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com