
分析 菱锰矿用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,过滤分离,滤液2中含有硫酸铵、硫酸钠等.
(1)滤渣1中,含铁元素的物质主要是氢氧化铁;加NaOH调节溶液的pH约为5,如果pH过大,可能导致滤渣1中氢氧化铝、二氧化硅溶解;
(2)滤液2中含有硫酸铵、硫酸钠等;
(3)①Mn2+被氧化,(NH4)2S2O8中S元素还原为硫酸根;
②由Mn元素守恒、电子转移守恒,可得关系式:Mn2+~MnO4-~5Fe2+,结合关系式计算;
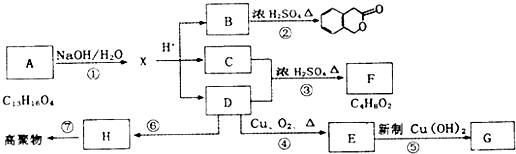
(4)①由图可知,NH4HCO3初始浓度越大,锰元素回收率越高;NH4HCO3初始浓度越大,溶液中碳酸根离子浓度越大,根据溶度积可知溶液c(Mn2+)越小;
②若溶液中c(Mn2+)=1.0 mol•L-1,加入等体积1.8 mol•L-1NH4HCO3溶液进行反应,混合后NH4HCO3溶液浓度为0.9mol/L,为图象中d曲线,根据回收率可以计算△c(Mn2+),进而计算20~40 min内v(Mn2+).
解答 解:菱锰矿用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,过滤分离,滤液2中含有硫酸铵、硫酸钠等.
(1)滤渣1中,含铁元素的物质主要是Fe(OH)3;加NaOH调节溶液的pH约为5,如果pH过大,可能导致滤渣1中SiO2、Al(OH)3溶解;
故答案为:Fe(OH)3;SiO2、Al(OH)3;
(2)滤液2中含有硫酸铵、硫酸钠等,+1价阳离子除了H+外还有:Na+、NH4+,
故答案为:Na+、NH4+;
(3)①Mn2+被氧化,(NH4)2S2O8中S元素还原为SO42-,
故答案为:SO42-;
②由Mn元素守恒、电子转移守恒,可得关系式:Mn2+~MnO4-~5Fe2+,则n(Mn2+)=$\frac{1}{5}$n(Fe2+),所以c(Mn2+)=$\frac{1}{5}$×$\frac{V×10{\;}^{-3}L×bmol/L}{a×10{\;}^{-3}L}$=$\frac{bV}{5a}$mol/L,
故答案为:$\frac{bV}{5a}$;
(4)①由图可知,NH4HCO3初始浓度越大,锰元素回收率越高;NH4HCO3初始浓度越大,溶液中c(CO32-)度越大,根据溶度积Ksp(MnCO3)=c(Mn2+)×c(CO32-)可知溶液c(Mn2+)越小,析出的MnCO3越多,
故答案为:高;NH4HCO3初始浓度越大,溶液中c(CO32-)度越大,根据溶度积Ksp(MnCO3)=c(Mn2+)×c(CO32-)可知溶液c(Mn2+)越小,析出的MnCO3越多;
②若溶液中c(Mn2+)=1.0 mol•L-1,加入等体积1.8 mol•L-1NH4HCO3溶液进行反应,混合后NH4HCO3溶液浓度为0.9mol/L,为图象中d曲线,20~40 min内△c(Mn2+)=1mol/L×$\frac{1}{2}$×(50%-20%)=0.15mol/L,则20~40 min内v(Mn2+)=$\frac{0.15mol/L}{(40-20)min}$=0.0075mol/(L.min),
故答案为:0.0075mol/(L.min).
点评 本题考查物质准备工艺流程,涉及混合物的分离和提纯、氧化还原反应滴定、信息获取与迁移运用等,侧重考查学生对知识的综合运用能力,需要学生具备扎实的基础.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液中加足量Ba(OH)2 溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| B. | 酸性溶液中KIO3与 KI反应生成 I2:IO3-+I-+6H+=I2+3H2O | |
| C. | NaHCO3 溶液与稀硫酸反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ④
④ .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| J | ||||
| R |
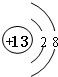 ;元素T周期表中位于第ⅦA族.
;元素T周期表中位于第ⅦA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100ml 2mol/LFeCl3溶液 | B. | 75ml 1mol/LMgCl2溶液 | ||
| C. | 150ml 3mol/LKCl溶液 | D. | 25ml 2mol/LAlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢能源的优点是来源广泛、无污染、便于运输与贮存 | |
| B. | 自然界中利用太阳能最成功的是植物的光合作用 | |
| C. | 植物秸秆、动物粪便、枯枝败叶中蕴藏着丰富的生物质能 | |
| D. | 利用太阳能、风能和氢能替代化石能源能改善空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cl2>I2 | B. | SiCl4>CCl4 | ||
| C. | NH3>PH3 | D. | C(CH3)4>CH3CH2CH2CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ③④⑤ | C. | ①③④⑤ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com