
| A. | 2,5-二甲基己烷 | B. | 2,3-二甲基丁烷 | ||
| C. | 2,3,4-三甲基戊烷 | D. | 2,2,3,3-四甲基丁烷 |
分析 化合物的核磁共振氢谱中出现三组峰说明有机物中含有三种类型的氢原子,根据等效氢的判断方法来回答,等效氢应有以下三种情况:①同一碳原子上的氢原子等效;②同一碳原子的甲基上的氢原子等效;③关于镜面对称碳原子上的氢原子等效.
解答 解:A.2,5-二甲基-己烷中有3种H原子,核磁共振氢谱中有3组吸收峰,故A正确;
B.3,4-二甲基-己烷中有4种H原子,核磁共振氢谱中有4组吸收峰,故B错误;
C.2,3,4-三甲基-戊烷中有4种H原子,核磁共振氢谱中有4组吸收峰,故C错误;
D.2,2,3,3-四甲基-丁烷中有1种H原子,核磁共振氢谱中有1组吸收峰,故D错误.
故选A.
点评 本题考查核磁共振氢谱,难度不大,注意利用等效氢原子知识判断.


科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的电子式: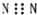 | |
| B. | 甲烷分子的比例模型是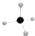 | |
| C. | 硝基和二氧化氮两种粒子所含电子数相等 | |
| D. | 中子数为10的氧原子:${\;}_{8}^{10}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,写出Cl在周期表中的位置第三周期VIIA族.
,写出Cl在周期表中的位置第三周期VIIA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4 | B. | C2H2 | C. | C3H4 | D. | C4H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅制作的光导纤维遇强碱会“断路” | |
| B. | 煤的综合利用主要是通过煤的干馏、液化和气化以获得洁净的燃料和多种化工原料 | |
| C. | 氢气燃烧能放出大量的热量,燃烧产物是水,所以是理想的清洁燃料 | |
| D. | 化学电源有一次电池和二次电池之分,一次电池用过之后不能复原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com