
【题目】取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。则下列说法错误的是( )
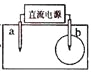
A. b电极是阴极B. a电极与电源的正极相连
C. 电解过程中水是氧化剂D. b电极附近溶液的pH变小
【答案】D
【解析】
惰性电极电解饱和食盐水,总反应为2Cl-+2H2O![]() H2↑+Cl2↑+2OH-,阴极:2H++2e-= H2↑,阳极:2Cl—2e-= Cl2↑。根据题意a电极与试纸接触处出现一个双色同心圆,内圆为白色,外圈呈浅红色,说明a电极先生成氯气,漂白pH试纸,后OH-放电生成氧气,氢氧根浓度降低,酸性增强,故pH试纸外圈呈红色。故a极为阳极,与电源正极相连,b为阴极与电源负极相连,据此分析解答。
H2↑+Cl2↑+2OH-,阴极:2H++2e-= H2↑,阳极:2Cl—2e-= Cl2↑。根据题意a电极与试纸接触处出现一个双色同心圆,内圆为白色,外圈呈浅红色,说明a电极先生成氯气,漂白pH试纸,后OH-放电生成氧气,氢氧根浓度降低,酸性增强,故pH试纸外圈呈红色。故a极为阳极,与电源正极相连,b为阴极与电源负极相连,据此分析解答。
A项,由分析可知,b电极为阴极,故A项正确;
B项,a电极为阳极与电源正极相连,故B项正确;
C项,电解过程中,水分子中氢元素由+1价降为0价,被还原,为氧化剂,故C项正确;
D项,b为阴极与电源负极相连,电极式为2H++2e-= H2↑,氢离子浓度降低,氢氧根浓度升高,故溶液pH变大,故D项错误。
答案选D。


科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.氨气通入醋酸溶液中 CH3COOH+NH3=CH3COONH4
B.澄清的石灰水跟盐酸反应 H++OH-=H2O
C.碳酸钡溶于醋酸 BaCO3+2H+=Ba2++H2O+CO2↑
D.金属钠跟水反应 2Na+H2O=2Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:ZnS呈白色,CuS呈黑色;常温下,Ksp(ZnS)=3.0×10-25,Ksp(CuS)=1.0×10-36;pM=-lgc(M2+)。常温下,向10.0mL0.20molL-1ZnCl2溶液中逐滴滴加0.10molL-1Na2S溶液,溶液中pM与加入Na2S溶液的体积(V)的关系如图所示。下列说法不正确的是( )
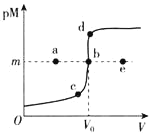
A.V0=20.0mL,m=12.5-![]() lg3
lg3
B.相同实验条件下,若用10.0mL0.20molL-1CuCl2溶液代替上述ZnCl2溶液,则反应终点b向d方向移动
C.若c(ZnCl2)=0.10molL-1,则反应终点可能为e点
D.向b点浊液中加入0.002molCuCl2固体,白色沉淀变黑色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cr(OH)3是类似Al(OH)3的两性氢氧化物,Ksp[Al(OH)3]=1.3×10-33,Ksp[Cr(OH)3]=6.3×10-31。如图为Cr和Al两种元素在水溶液中存在的形式与pH的关系,图中纵轴表示lgc(M3+)或lgc[M(OH)4-](其中M=Al或Cr)。下列说法错误的是( )
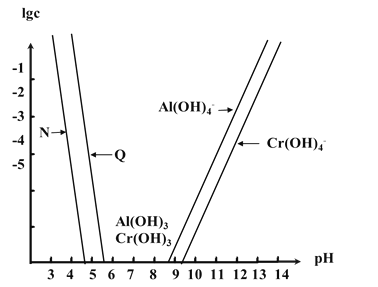
A.曲线N表示Al3+的浓度变化
B.在Al(OH)3和Cr(OH)3混合悬浊液中滴加NaOH溶液,Al(OH)3先溶解
C.在Al(OH)3和Cr(OH)3共沉淀的体系中![]() ≈4.8×102
≈4.8×102
D.若溶液中Al3+和Cr3+起始浓度均为0.1molL-1,通过调节pH能实现两种元素的分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图。下列分析不正确的是( )

A. a~b点导电能力增强说明HR为弱酸
B. a、b点所示溶液中水的电离程度不相同
C. b恰好完全中和,pH=7说明NH4R没有水解
D. c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,已知0-t1时,原电池的负极是Al片,反应过程中有红棕色气体产生。下列说法不正确的是
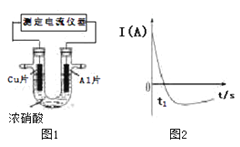
A. 0-t1时,正极的电极反应式为:2H++ NO3- - e-=NO2+ H2O
B. 0-t1时,溶液中的H+ 向Cu电极移动
C. t1时,负极的电极反应式为:Cu–2e-= Cu2+
D. t1时,原电池中电子流动方向发生改变是因为Al在浓硝酸中钝化,氧化膜阻碍了Al的进一步反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL,溶液pH数值范围为___________,溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]___________(填“增大”“减小”“不变”或“不能确定”)。
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=___________。用pH试纸测定该氨水pH的操作方法为_______________________________________________________。
③氨水(NH3·H2O溶液)电离平衡常数表达式Kb=_______________________________,25 ℃时,氨水电离平衡常数约为___________。
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中c(NH4+)/c(NH3.H2O)___________(填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。

图中M、Q、N三点所示溶液呈中性的点是___________(填字母,下同)。
图中M、Q、N三点所示溶液中水的电离程度最大的点可能是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Al、CuO、Fe2O3组成的混合物共10.0g,放入500mL某浓度的盐酸中,混合物完全溶解,当再加入250mL 2.00mol/L的NaOH溶液时,得到沉淀最多。上述盐酸的浓度为( )
A. 1.00 mol/LB. 0.500 mol/L
C. 2.00 mol/LD. 3.00 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示各物质是由1~20号元素中部分元素组成的单质或化合物,图中部分反应条件未列出。已知D、L、M为气体单质,C、E、H为气体化合物,反应②、④、⑥是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。
请回答下列问题:
(1)物质E的结构式为 __________。
(2)属于化合反应,但不属于氧化还原反应的是__________(用编号填空)。
(3)C、H的熔沸点比较:C___H(填““>”、“<”或“=”))原因是:________________。
(4)物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A的化学式为
______________。
(5)在一定温度下,有甲、乙两容积相等的密闭容器。
I.向甲容器中通入3 mol M和4 mol L,反应达到平衡时,生成C的物质的量为a mol。此时,M的转化率为__________。下列能提高反应物L的转化率,但实际生产过程中并没有采用的措施是_____________。
①降低合成塔温度 ②适当增大压强
③不断分离出产物C ④加入合适催化剂
II.向乙中通入2 mol C,欲使反应达到平衡时,各物质的浓度与I中第一次平衡时相同,则起始时还需通入__________mol M和__________mol L。
III.若起始时,向乙中通入6mol M和8mol L,达到平衡时,生成C的物质的量为b mol,
则![]() ________
________![]() (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com