
下列有关能量的判断或表示方法正确的是
| A.从C(石墨)=C(金刚石)ΔH=1.9 kJ·mol-1,可知金刚石比石墨更稳定 |
| B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| C.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ |
| D.2 gH2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1 |
D
解析试题分析:A.物质所含有的能量越低就越稳定。由于C(石墨)=C(金刚石)吸收能量,所以金刚石不如石墨更稳定。错误。B.等质量的硫蒸气比硫固体所含有的能量高,所以硫蒸汽完全燃烧,放出热量更多。错误。NaOH固体溶解于水会放出热量,所以向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量大于5.73 kJ。错误。D.2 gH2即1mol的氢气完全燃烧生成液态水放出285.8 kJ热量,则2mol的氢气燃烧放出热量为571.6 kJ。所以其燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1。正确。
考点:考查物质燃烧释放的能量与物质的状态、及热化学方程式的关系的知识。


科目:高中化学 来源: 题型:单选题
金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石并需要吸收能量,已知12克石墨或金刚石完全燃烧时放出的热量依次为Q1和Q2,下列说法错误的是( )
| A.Q1<Q2 |
| B.石墨不如金刚石稳定 |
| C.质量相等的石墨与金刚石,石墨具有的能量比金刚石低 |
| D.质量相等的石墨与金刚石完全燃烧,生成的二氧化碳一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用Cl2生产某些含氯有机物时会产生副产物HCl。 利用反应A:4HCl+O2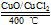 2Cl2+2H2O,
2Cl2+2H2O,
可实现氯的循环利用。
已知:Ⅰ.反应A中,4mol HCl被氧化,放出115.6kJ的热量.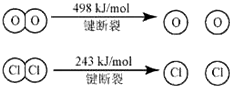
Ⅱ.则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为
| A.16kJ | B.24kJ | C.32kJ | D.48kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关中和热的说法正确的是( )
| A.表示中和热的热化学方程式:H+(l)+OH-(l)=H2O(l) ΔH=-57.3 kJ/mol |
| B.准确测量中和热的实验过程中,至少需测定温度4次 |
| C.中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小 |
| D.已知2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ/mol,则该反应的中和热为114.6 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+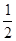 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是
| A.CH3OH转变成H2的过程一定要吸收能量 |
| B.①反应中,反应物的总能量高于生成物总能量 |
C.根据②推知反应:CH3OH(l)+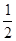 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 |
| D.反应②中的能量变化如下图所示 |
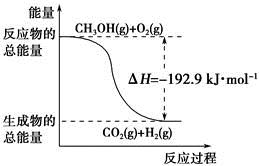
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
| A.需要加热方能发生的反应一定是吸热反应 |
| B.若反应为放热反应,则该反应不必加热就可发生 |
| C.放热反应比吸热反应容易发生 |
| D.化学反应都伴随着能量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,已知:
4Al(s)+3O2(g)=2Al2O3(s)ΔH1
4Fe(s)+3O2(g)=2Fe2O3(s)ΔH2
下面关于ΔH1、ΔH2的比较正确的是( )
| A.ΔH1>ΔH2 | B.ΔH1<ΔH2 |
| C.ΔH1=ΔH2 | D.无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3 kJ·mol-1;H2(g)+O2(g)=H2O(l) ΔH2=-285.8 kJ·mol-1。CO2气体与H2气体反应生成甲烷气体与液态水的热化学方程式为CO2(g)+4H2(g)=CH4(g)+2H2O(l)ΔH3,其中ΔH3的数值为( )
| A.-252.9 kJ·mol-1 | B.+252.9 kJ·mol-1 |
| C.-604.5 kJ·mol-1 | D.+604.5 kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com