
【题目】元素铬及其化合物工业用途广泛,但含+6价铬的污水会损害环境。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用直接沉淀法、还原沉淀法、电解法。
I.直接沉淀法
(1)已知含铬废水中存在着平衡:![]() 。在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为
。在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为
Ⅱ.还原沉淀法
![]()
(2)下列溶液中可以代替上述流程中Na2S2O3溶液的是 (填选项序号)
A.FeSO4溶液 B.浓H2SO4溶液
C.酸性KMnO4溶液 D.Na2SO3溶液
(3)上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发送反应的离子方程式为
(4)Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,原因可用离子方程式表示:
(5)实际工业生产中有时还采用阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR为阳离子交换树脂,Mn+为要测定的离子。
常温下,某次测定过程中,将pH=5的废水经过阳离子交换树脂后,测的溶液中Na+比交换前增加了4.6×10-2g/L,则该条件下Cr(OH)3的Ksp的值为 ,当Cr3+浓度小于10-5mol/L时可认为沉淀完全,处理后测得溶液的PH=6,则溶液过滤后 (填“能”或“否”)直接排放
Ⅲ.电解法
(6)该法是用铁作电极点解含Cr2O72-的酸性废水,电解时阴极上有大量气泡生成,并产生Cr(OH)3、Fe(OH)3沉淀,反应中1mol Cr2O72-完全生成Cr(OH)3沉淀,外电路通过的电子的物质的量为 mol
【答案】
Ⅰ、(1)BaCrO4;
Ⅱ、(2)AD;
(3)3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
(4)Cr(OH)3+OH-=CrO2-+2H2O;
(5)①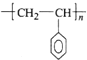 ;②6.7×10-31。
;②6.7×10-31。
【解析】
试题分析:Ⅰ、(1)含铬废水中存在着平衡:Cr2O72-+H2O2CrO42-+2H+.在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,氢氧根离子和氢离子反应生成水,促使平衡正向进行,有利于铬元素转化为铬酸钡沉淀,则生成沉淀的化学式为:BaCrO4;故答案为:BaCrO4;
Ⅱ、(2)可以代替上述流程中Na2S2O3溶液,需要具有还原性,能还原重铬酸根离子;A.FeSO4溶液中亚铁离子具有还原性,可以还原Cr2O72-离子,故A符合;B.浓H2SO4 具有强氧化性,不能表现还原性,不能还原Cr2O72-,故B不符合;C.酸性KMnO4 是强氧化剂不能还原Cr2O72-,故C不符合;D.Na2SO3溶液中亚硫酸根离子具有还原性,可以还原Cr2O72-,故D符合;故答案为:AD;
(3)每消耗0.1mol Na2S2O3转移0.8mol e-,Na2S2O3 ~2SO42-~8e-,Cr2O72-~2Cr3+~6e-,依据氧化还原反应电子守恒配平书写,3Na2S2O3 ~6SO42-~24e-,4Cr2O72-~8Cr3+~24e-,得到的氧化还原反应的离子方程式为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
(4)在上述生产过程中加入NaOH溶液时要控制溶液的PH不能过高,Cr(OH)3的化学性质与Al(OH)3相似,Cr(OH)3可以溶解在过量的氢氧化钠溶液中,可用离子方程式表示原因为:Cr(OH)3+OH-=CrO2-+2H2O;故答案为:Cr(OH)3+OH-=CrO2-+2H2O;
(5)①聚苯乙烯是苯乙烯一定条件下发生的加成聚合反应,生成了高分子化合物聚苯乙烯,其单体为苯乙烯(![]() CH=CH2),反应为:n
CH=CH2),反应为:n![]() CH=CH2→
CH=CH2→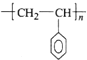 ,故答案为:
,故答案为: ;
;
②阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Cr3++3NaR═3Na++CrR3,其中NaR为阳离子交换树脂,Mn+为要测定的离子Cr3+,Na+比交换前增加了4.6×10-2gL-1,物质的量浓度=![]() ×102mol/L=2×10-3mol/L,计算被交换的离子Cr3+浓度=
×102mol/L=2×10-3mol/L,计算被交换的离子Cr3+浓度=![]() ×2×10-3mol/L,Cr(OH)3(s)3c(OH-)+c(Cr3+),将pH=5的废水经过阳离子交换树脂后,溶液中c(OH-)=10-9mol/L,Ksp=c3(OH-)c(Cr3+)=[10-9]3×
×2×10-3mol/L,Cr(OH)3(s)3c(OH-)+c(Cr3+),将pH=5的废水经过阳离子交换树脂后,溶液中c(OH-)=10-9mol/L,Ksp=c3(OH-)c(Cr3+)=[10-9]3×![]() ×2×10-3mol/L=6.7×10-31,故答案为:6.7×10-31。
×2×10-3mol/L=6.7×10-31,故答案为:6.7×10-31。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述不正确的是
A. 淀粉![]() 葡萄糖
葡萄糖![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
B. 纤维素![]() 葡萄糖
葡萄糖![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
C. 油脂![]() 甘油和高级脂肪酸
甘油和高级脂肪酸![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
D. 蛋白质![]() 氨基酸
氨基酸![]() 人体所需的蛋白质(人体生长发育)
人体所需的蛋白质(人体生长发育)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
①31g白磷含有的P-P键数为N A
②1molCH3+(碳正离子)中含有电子数为10NA
③1mol铜与足量硫蒸气反应,转移电子数为2NA
④1mol Mg与足量O2或N2反应生成MgO或Mg3N2,均失去2N A 个电子
⑤用惰性电极电解CuCl2溶液,阴极析出16g铜时,线路中通过电子数为N A
⑥0.84gNaHCO3晶体中阳离子和阴离子总数为0.03N A
⑦3.9gNa2O2吸收足量的CO2时转移的电子数是0.05 N A
⑧标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1N A
⑨28g C16O与28g C18O中含有的质子数均为14×6.02×1023
⑩标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2×6.02×1023
A.②④⑦⑧ B.③④⑥⑦⑧ C.④⑦ D.④⑥⑨⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是食用碘盐包装上的部分说明,下列说法正确的是( )
配料 | 精盐、碘酸钾、抗结剂 |
碘含量 | 35±15 mg·kg-1 |
储存方法 | 密封、避光、防潮 |
食用方法 | 烹饪时,待食品熟后加入碘盐 |
A.高温会导致碘的损失 B.碘酸钾可氧化氯化钠
C.可用淀粉检验碘盐中的碘酸钾 D.该碘盐中碘酸钾含量为20~50 mg·kg-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是________________。
(2)烧杯间填满碎纸条的作用__________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 ___________(“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 ________( “变多”“变少”“不变”),所求中和热_______(“相等、不相等”)
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会_____________(“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于吸热反应的是( )
A.炭燃烧生成一氧化碳 B.Ba(OH)2·8H2O与NH4Cl反应
C.锌粒与稀硫酸反应制取H2 D.中和反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com