
| A. | 将实验完剩余的金属钠放回原试剂瓶中 | |
| B. | 测定熔融氢氧化钠的导电性,可在铁质坩埚中熔化氢氧化钠固体后进行测量 | |
| C. | 制备Fe(OH)3胶体通常是将饱和氯化铁溶液煮沸,直至呈红褐色时停止加热 | |
| D. | 在饱和NaOH溶液中加一定量Na2O2,充分反应后恢复到原温度,有晶体析出,溶液质量不变 |
分析 A.钠性质活泼,易与水、氧气反应,若在实验室随意丢弃,易引起火灾;
B.瓷坩埚中含有二氧化硅,在加热条件下能与氢氧化钠反应,而铁坩埚不与熔融氢氧化钠反应;
C.将饱和氯化铁溶液逐滴滴入沸水中直至变成红褐色可制备Fe(OH)3胶体;
D.由于过氧化钠与水反应,消耗了溶剂,导致溶液质量减小.
解答 解:A.因钠活泼,易与水、氧气反应,若在实验室随意丢弃,可引起火灾,实验时剩余的钠粒可放回原试剂瓶中,故A正确;
B.熔融氢氧化钠能够与瓷坩埚中的二氧化硅反应,则测定熔融氢氧化钠的导电性,应该在铁质坩埚中熔化氢氧化钠固体后进行测量,故B正确;
C.制备Fe(OH)3胶体的正确方法是:将饱和氯化铁溶液逐滴滴入沸水中直至变成红褐色,故C错误;
D.在饱和NaOH溶液中加一定量Na2O2,充分反应后恢复到原温度,有晶体析出,由于过氧化钠消耗了水,导致反应后溶液的质量减小,故D错误;
故选AB.
点评 本题考查化学实验方案的评价,涉及化学试剂的保存、氢氧化铁胶体的制备、饱和溶液特点等知识,明确常见元素及其化合物性质为解答关键,注意掌握氢氧化铁胶体的制备方法,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 实验剩余的药品不能放回原试剂瓶 | |
| B. | 点燃可燃性气体前必须验纯 | |
| C. | 气体实验装置在实验前要进行气密性检查 | |
| D. | 滴管不能交叉使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
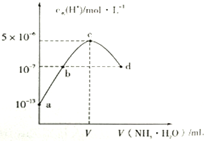 常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )
常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )| A. | V=40 | |
| B. | C点所示溶液中:c(H+)-c(OH-)═2c(NH3.H2O) | |
| C. | NH3.H2O的电离常数K=10-4 | |
| D. | d点所示溶液中:c(NH4+)═2c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(CaO) | B. | Na2O2(Na2O) | C. | Na2CO3(NaHCO3) | D. | MgO[Mg(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 1 | 2 | 3 | 4 |
| Na2S2O3溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 20.01 | 20.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2 氧化还原反应 | |
| B. | N2+3H2$?_{高温高压}^{催化剂}$2NH3可逆反应 | |
| C. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl 置换反应 | |
| D. | CH2=CH2+Br2→CH2Br-CH2Br 加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序:r(Z)>r(W)>r(Y) | |
| B. | Y的简单气态氢化物的热稳定性比W的强 | |
| C. | Z和Y形成的原子个数比为1:1和2:1的化合物中化学键类型相同 | |
| D. | X的最高价氧化物对应水化物的酸性比W的弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com