
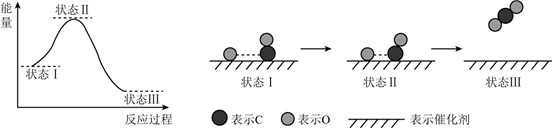
| A. | CO和O生成CO2是吸热反应 | |
| B. | 在该过程中,CO断键形成C和O | |
| C. | CO和O生成了具有极性共价键的CO2 | |
| D. | 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定 | |
| B. | 随着NaOH溶液滴入,锥形瓶中溶液pH由小变大 | |
| C. | 用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定 | |
| D. | 滴定终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
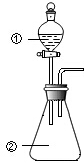 用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( ) | 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
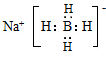 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
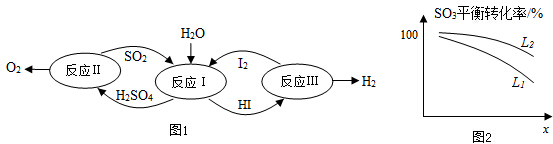
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
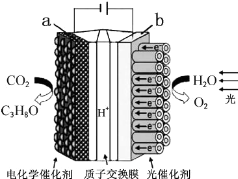
| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从b极区向a极区迁移 | |
| C. | 每生成1mol O2,有44g CO2被还原 | |
| D. | a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H6、CH2═CHCH3 | B. | H2O2、 | C. | 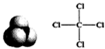 | D. |  1S22S22p63S23p6 1S22S22p63S23p6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com