
 A”«IĪŖ֊ѧ»Æѧ֊³£¼ūµÄĪļÖŹ£¬B”¢E”¢FĪŖµ„ÖŹ£¬ĒŅŌŚ³£ĪĀĻĀBŹĒŅ»ÖÖ»ĘĀĢÉ«ÓŠ¶¾ĘųĢ壬EĪŖ×ĻŗģÉ«½šŹō£¬GĪŖŗŚÉ«¹ĢĢ壮ĖüĆĒµÄĻą»„×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£Ø²æ·ÖÉś³ÉĪļĪ“ĮŠ³ö£©£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
A”«IĪŖ֊ѧ»Æѧ֊³£¼ūµÄĪļÖŹ£¬B”¢E”¢FĪŖµ„ÖŹ£¬ĒŅŌŚ³£ĪĀĻĀBŹĒŅ»ÖÖ»ĘĀĢÉ«ÓŠ¶¾ĘųĢ壬EĪŖ×ĻŗģÉ«½šŹō£¬GĪŖŗŚÉ«¹ĢĢ壮ĖüĆĒµÄĻą»„×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£Ø²æ·ÖÉś³ÉĪļĪ“ĮŠ³ö£©£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ £®
£®·ÖĪö A”«IĪŖ֊ѧ»Æѧ֊³£¼ūµÄĪļÖŹ£¬B”¢E”¢FĪŖµ„ÖŹ£¬³£ĪĀĻĀBŹĒŅ»ÖÖ»ĘĀĢÉ«ÓŠ¶¾ĘųĢ壬ŌņBĪŖCl2£¬EĪŖ×ĻŗģÉ«½šŹō£¬ŌņEŹĒCu£¬FŹĒŅ»ÖÖŃõ»ÆĪļĖ×³Ę”°Ģśŗģ”±£¬³£ÓĆ×÷ŗģÉ«ÓĶĘįŗĶĶæĮĻ£¬ŌņFĪŖFe£¬ŌņCĪŖFeCl3£¬DĪŖFeCl2£¬HĪŖFe£ØOH£©2£¬IĪŖFe£ØOH£©3£¬AÓėFe·“Ó¦µĆµ½ĀČ»ÆŃĒĢś£¬ÓėŗŚÉ«¹ĢĢå·“Ó¦µĆµ½ĀČĘų£¬ŌņAĪŖHCl£¬BĪŖMnO2£®
½ā“š ½ā£ŗA”«IĪŖ֊ѧ»Æѧ֊³£¼ūµÄĪļÖŹ£¬B”¢E”¢FĪŖµ„ÖŹ£¬³£ĪĀĻĀBŹĒŅ»ÖÖ»ĘĀĢÉ«ÓŠ¶¾ĘųĢ壬ŌņBĪŖCl2£¬EĪŖ×ĻŗģÉ«½šŹō£¬ŌņEŹĒCu£¬FŹĒŅ»ÖÖŃõ»ÆĪļĖ×³Ę”°Ģśŗģ”±£¬³£ÓĆ×÷ŗģÉ«ÓĶĘįŗĶĶæĮĻ£¬ŌņFĪŖFe£¬ŌņCĪŖFeCl3£¬DĪŖFeCl2£¬HĪŖFe£ØOH£©2£¬IĪŖFe£ØOH£©3£¬AÓėFe·“Ó¦µĆµ½ĀČ»ÆŃĒĢś£¬ÓėŗŚÉ«¹ĢĢå·“Ó¦µĆµ½ĀČĘų£¬ŌņAĪŖHCl£¬BĪŖMnO2£®
£Ø1£©BĪŖĀČĘų£¬ĀČŌ×Ó½į¹¹Ź¾ŅāĶ¼ĪŖ £¬¹Ź“š°øĪŖ£ŗ
£¬¹Ź“š°øĪŖ£ŗ £»
£»
£Ø2£©FŹĒŅ»ÖÖŃõ»ÆĪļĖ×³Ę”°Ģśŗģ”±£¬³£ÓĆ×÷ŗģÉ«ÓĶĘįŗĶĶæĮĻ£¬ÕāÖÖŃõ»ÆĪļĪŖFe2O3£¬¹Ź“š°øĪŖ£ŗFe2O3£»
£Ø3£©CuÓėFeCl3·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗCu+2Fe3+=2Fe2++Cu2+£¬¹Ź“š°øĪŖ£ŗCu+2Fe3+=2Fe2++Cu2+£»
£Ø4£©FeCl2ÓėĀČĘų·“Ӧɜ³ÉFeCl3£¬·“Ó¦Ąė×Ó·½³ĢŹ½ĪŖ£ŗCl2+2Fe2+=2Fe3++2Cl-£¬¹Ź“š°øĪŖ£ŗCl2£»Cl2+2Fe2+=2Fe3++2Cl-£»
£Ø5£©Č”ÉŁŠķDČÜŅŗÓŚŹŌ¹ÜÖŠ£¬¼ÓČėKSCNČÜŅŗ£¬ČōČÜŅŗ±äĪŖŗģÉ«£¬ĖµĆ÷DČÜŅŗÖŠŗ¬ÓŠFeCl3£¬·ńŌņ²»ŗ¬FeCl3£¬
¹Ź“š°øĪŖ£ŗȔɣŠķDČÜŅŗÓŚŹŌ¹ÜÖŠ£¬¼ÓČėKSCNČÜŅŗ£¬ČōČÜŅŗ±äĪŖŗģÉ«£¬ĖµĆ÷DČÜŅŗÖŠŗ¬ÓŠFeCl3£¬·ńŌņ²»ŗ¬FeCl3£®
µćĘĄ ±¾Ģāæ¼²éĪŽ»śĪļĶʶĻ£¬ĪļÖŹµÄŃÕÉ«¼°FµÄŃõ»ÆĪļĪŖĶʶĻĶ»ĘĘæŚ£¬ŹģĮ·ÕĘĪÕŌŖĖŲ»ÆŗĻĪļŠŌÖŹÓėŹµŃéŹŅĀČĘųµÄÖʱø£¬ÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | CH3COOHµÄµēĄė³Ģ¶Č±ä“ó | B£® | c£ØCH3COO-£©Ōö“ó | ||
| C£® | CH3COOHµÄKa²»±ä | D£® | ČÜŅŗµÄpHŌö“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
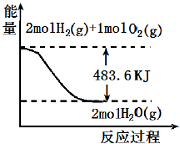
| A£® | ±ķŹ¾ 2molH2 £Øg£©ĶźČ«Č¼ÉÕÉś³ÉĖ®ÕōĘųĪüŹÕ241.8 kJČČĮæ | |
| B£® | ±ķŹ¾µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗH2£Øg£©+$\frac{1}{2}$02£Øg£©ØTH20£Øg£©”÷H=-241.8 kJ/mol | |
| C£® | ±ķŹ¾2mol H2£Øg£©Ėł¾ßÓŠµÄÄÜĮæŅ»¶Ø±Č2 molĘųĢ¬Ė®Ėł¾ßÓŠµÄÄÜĮæ¶ą483.6 kJ | |
| D£® | H20£Øg£©µÄÄÜĮæµĶÓŚH2£Øg£©ŗĶO2£Øg£©µÄÄÜĮæÖ®ŗĶ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | øßĪĀĻĀ½¹Ģ滹Ō¶žŃõ»Æ¹čÖĘµĆ“Ö¹č | |
| B£® | æÉÓĆNa“ÓTiCl4µÄĖ®ČÜŅŗÖŠÉś²śTi | |
| C£® | æÉÓĆCOøßĪĀĻĀ»¹Ō³ąĢśæóĮ¶Ģś | |
| D£® | æÉÓĆŹÆÓ¢”¢ŹÆ»ŅŹÆ”¢“æ¼īŌŚøßĪĀĻĀÉś²ś²£Į§ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ČÜŅŗŗĶ½ŗĢåµÄ±¾ÖŹĒų±šŹĒ·ńÓŠ¶”“ļ¶ūŠ§Ó¦ | |
| B£® | ÓĆpHŹŌÖ½²ā¶ØijŠĀÖĘĀČĖ®µÄpHĪŖ4 | |
| C£® | ĖįŠŌŃõ»ÆĪļ²»Ņ»¶Ø¶¼æÉÓėĖ®·“Ӧɜ³ÉĖį£¬½šŹōŃõ»ÆĪļ²»Ņ»¶ØŹĒ¼īŠŌŃõ»ÆĪļ | |
| D£® | ÉŁĮæSO2ŗĶCO2ĘųĢå·Ö±šĶØČėBaCl2ČÜŅŗÖŠ¾łÓŠ°×É«³Įµķ²śÉś |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| ČõĖį | CH3COOH | HCN | H2CO3 |
| µēĄėĘ½ŗā³£Źż | 1.8”Į10-5 | 4.9”Į10-10 | K1=4.3”Į10-7 K2=5.6”Į10-11 |
| A£® | µČĪļÖŹµÄĮæÅضČČÜŅŗµÄpH¹ŲĻµĪŖpH£ØNaCN£©£¾pH£ØNa2CO3£©£¾pH£ØCH3COONa£© | |
| B£® | a mol•L-1HCNČÜŅŗÓėb mol•L-1NaOHČÜŅŗµČĢå»ż»ģŗĻŗó£¬ĖłµĆČÜŅŗÖŠ£ŗc£ØNa+£©£¾c£ØCN-£©£¬ŌņaŅ»¶ØŠ”ÓŚb | |
| C£® | Ķł±ł“×ĖįÖŠÖšµĪ¼ÓĖ®£¬ČÜŅŗµÄµ¼µēŠŌÖš½„Ōö“ó | |
| D£® | ½«0.2 mol•L-1 KHCO3ČÜŅŗÓė0.1 mol•L-1 KOHČÜŅŗµČĢå»ż»ģŗĻ£ŗc£ØK+£©+c£ØH+£©=c£ØOH-£©+c£ØHCO${\;}_{3}^{-}$£©+2c£ØCO${\;}_{3}^{2-}$£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
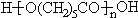 }¼°×čČ¼¼ĮĖÄäåĖ«·ÓA£®ŗĻ³ÉĻßĀ·ČēĻĀ£ŗ
}¼°×čČ¼¼ĮĖÄäåĖ«·ÓA£®ŗĻ³ÉĻßĀ·ČēĻĀ£ŗ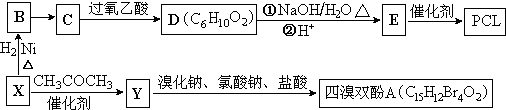


 £®
£®
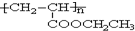 £¬Š“³öŗĻ³ÉøĆĶæĮĻµÄ·“Ó¦Į÷³ĢĶ¼£ŗ
£¬Š“³öŗĻ³ÉøĆĶæĮĻµÄ·“Ó¦Į÷³ĢĶ¼£ŗ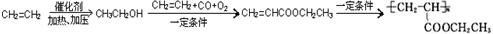 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| ČõĖįµÄ»ÆѧŹ½ | CH3COOH | HCN | H2S |
| µēĄė³£Źż | 1.8”Į10-5 | 4.9”Į10-10 | K1=1.3”Į10-7 K2=7.1”Į10-15 |
| A£® | µČĪļÖŹµÄĮæÅØ¶ČµÄø÷ČÜŅŗ£¬pH¹ŲĻµĪŖ£ŗpH£ØCH3COONa£©£¾pH£ØNa2S£©£¾pH£ØNaCN£© | |
| B£® | a mol/L HCNČÜŅŗÓėb mol/LNaOHČÜŅŗµČĢå»ż»ģŗĻ£¬ĖłµĆČÜŅŗÖŠc£Ø Na+£©£¾c£ØCN-£©£¬Ōņa Ņ»¶ØŠ”ÓŚ»ņµČÓŚb | |
| C£® | NaHSŗĶNa2SµÄ»ģŗĻČÜŅŗÖŠ£¬Ņ»¶Ø“ęŌŚc£ØNa+£©+c£ØH+£©=c£ØOH-£©+c£ØHS-£©+2c£ØS2-£© | |
| D£® | ½«ÉŁĮæµÄH2SĶØČėNaCNČÜŅŗÖŠ£¬·“Ó¦ĪŖ£ŗH2S+2CN-=2HCN+S2- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | SiO2ŹĒÖĘŌģĢ«ŃōÄܵē³Ų°åµÄÖ÷ŅŖ²ÄĮĻ | |
| B£® | NO”¢NO2ŹĒ“óĘųĪŪČ¾Īļ£¬ÄÜŌŚæÕĘųÖŠĪČ¶Ø“ęŌŚ | |
| C£® | ĘÆ°×¾«µÄÓŠŠ§³É·ÖŹĒCa£ØClO£©2 | |
| D£® | FeÓėS»ÆŗĻÉś³ÉFe2S3 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com