
【题目】现有20mL浓度为0.04mol·L-1的Na2SO3溶液恰好与10mL浓度为0.02mol·L-1的K2A2O7溶液完全反应。已知Na2SO3可被K2A2O7氧化为Na2SO4,则元素A在还原产物中的化合价为( )
A.+2B.+3C.+4D.+5
科目:高中化学 来源: 题型:
【题目】一定条件下,反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-a kJ·mol-1 在5 L密闭容器中进行,10 s时,水蒸气的物质的量增加了0.60 mol。则下列说法不正确的是( )
4NO(g)+6H2O(g) ΔH=-a kJ·mol-1 在5 L密闭容器中进行,10 s时,水蒸气的物质的量增加了0.60 mol。则下列说法不正确的是( )
A. 10 s内,NH3的平均反应速率为0.008 mol·L-1·s-1
B. 该反应达到平衡时6v正(O2)=5v逆(H2O)
C. 10 s内,反应放出的热量为0.1a kJ
D. 10 s时,H2O的反应速率为0.012 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2C2O4是二元弱酸,室温下向某浓度的草酸溶液中逐滴加入KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-的组成百分率与pH的关系如图所示,下列说法正确的是
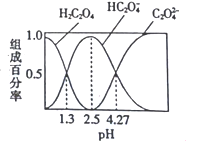
A. pH=4.27的溶液中:c(K+)+c(H+)=c(OH-)+3c(C2O42-)
B. 反应HC2O4-+H2O![]() H2C2O4+OH-的平衡常数为10-4.27
H2C2O4+OH-的平衡常数为10-4.27
C. 向溶液中加入KOH溶液将pH由1.3调至4.27的过程中水的电离程度先增大后减小
D. pH=2.5的溶液中:c(H+)+2c(H2C2O4)=c(OH-)+c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰基烯酸酯在碱性条件下能快速聚合为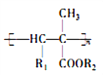 ,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:
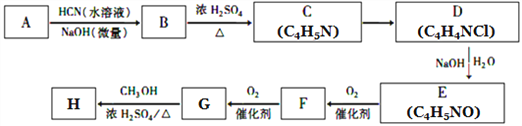
已知:①A的相对分子量为58,氧元素质量分数为0. 276,核磁共振氢谱显示为单峰;
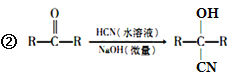
回答下列问题:
(1)A的化学名称为____________。
(2)C的结构简式为________________,F中的含氧官能团名称是________________。
(3)由E生成F的反应类型为_____________,由G生成H的反应类型为_____________。
(4)由G生成H的化学方程式为________________________________。
(5)写出A的能够发生银镜反应的同分异构体的结构简式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝镁合金已成为飞机制造、化工生产等行业的重要材料.某研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计下列实验方案进行探究。填写下列空白。
[实验方案]
将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况下(约20℃,1.01×105 Pa)的体积。
[问题讨论]
(1)同学们拟选用下列实验装置完成实验:

①你认为最简易的装置其连接顺序是:
A接(____)( )接( )( )接( )( )。(填接口字母,可不填满)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶.请你帮助分析原因_______________________________。
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图所示的实验装置。

(碱式滴定管上的刻度数值上小下大)
①装置中导管a的作用是____________________________________________________。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL.则产生氢气的体积为________ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烯烃与H2发生加成反应后得到的产物是CH3CH(CH3)2.
(1)该产物的系统命名的名称为______,写出该产物的同分异构体的结构简式______
(2)光照条件下,该产物与氯气反应,生成含两个甲基的一氯代物,写出反应的化学方程式______________________ ,反应类型是______________
(3)原来烯烃的结构简式为:______,系统命名的名称为______________
(4)写出该烯烃一定条件下发生加聚反应的方程式:_____________;
(5)写出原来的烯烃使溴的四氯化碳溶液褪色的化学反应方程式:____; 反应类型是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对中学课本中可生成氢气的反应进行了研究,总结出两个可以生成H2的反应:①Zn+盐酸;②Na+水。为点燃经验纯后上述两个反应生成的H2,他们设计了图示装置。请回答下列问题:

(1)写出Na与H2O反应的化学方程式:__。
(2)实验小组在点燃用上述装置制得的H2时,实验①获得成功,实验②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是__。
(3)实验小组查阅资料知钠、煤油、水的密度分别为0.97 g·cm-3、0.8 g·cm-3、1.00 g·cm-3,并据此对实验进行改进,在改进后的实验中H2的生成速率减慢,原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A. KOH的摩尔质量是56g
B. 一个二氧化碳分子的质量就是其相对分子质量
C. 硫原子的摩尔质量就是硫的相对原子质量
D. 氦气的摩尔质量以克每摩尔为单位时在数值上等于它的相对原子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了从KCl和MnO2的混合物中回收MnO2,下列操作顺序正确的是(已知MnO2为黑色难溶于水的固体)( )
A.溶解 过滤 蒸发 洗涤B.溶解 过滤 洗涤 干燥
C.溶解 过滤 蒸发 干燥D.溶解 洗涤 过滤 干燥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com