
| 编号 | NaOH/mol•L-1 | HA/mol•L-1 | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH<7 |
分析 (1)弱电解质的电离是可逆的,不能完全电离;pH测定操作方法是先把一小块pH试纸放在表面皿或玻璃片上,再用玻璃棒蘸驭溶液点在试纸的中部,待变色后,与标准比色卡对比确定溶液的pH;
(2)精确取pH=1的HA溶液和稀盐酸个10.00mL,用酸式滴定管;pH均为1的HA溶液和稀盐酸中,说明氢离子浓度相等,根据水的离子积,得到氢氧根离子浓度相等,所以两种溶液中水的定量程度相同;
(3)弱酸在水溶液里部分电离,所以氢离子浓度小于酸浓度;酸和锌反应时生成氢气,反应速率和氢离子浓度成正比,根据生成氢气的反应速率确定酸的强弱;
(4)若酸为强酸,等体积等浓度混合时pH=7;而HA为弱酸,等体积等浓度混合溶液的pH大于7,则为保证pH=7,应使酸浓度大于0.1mol/L;并结合电荷守恒分析离子浓度关系;
(5)由③组实验结果可知,混合后为HA与NaA的混合液,pH=7,酸的电离等于盐的水解.
解答 解:(1)甲测定溶液PH的具体操作方法是先把一小块pH试纸放在表面皿或玻璃片上,再用玻璃棒蘸驭溶液点在试纸的中部,待变色后,与标准比色卡对比确定溶液的pH,
故答案为:>;先把一小块pH试纸放在表面皿或玻璃片上,再用玻璃棒蘸驭溶液点在试纸的中部,待变色后,与标准比色卡对比确定溶液的pH;
(2)在乙的方案的第①步中,准确量取10.00mL的酸溶液需要用到的定量仪器是酸式滴定管,pH均为1的HA溶液和稀盐酸中氢离子浓度相同,所以水的电离程度的相同,
故答案为:酸式滴定管;c;
(3)pH相等的一元酸,弱酸的浓度大于强酸,等体积等PH的醋酸和盐酸稀释相同倍数时,醋酸中氢离子浓度大于盐酸,分别和锌反应时,弱酸生成氢气的反应速率大于强酸,故B正确,
故答案为:B;
(4)丙的方案中通过编号①的数据证明HA为弱酸,若等体积、等浓度混合溶液呈碱性,编号②中呈中性,所以c>0.l,根据电荷守恒,该混合液中的离子浓度:c(Na+)=c(A-),
故答案为:>;=;
(5)丙的方案中,编号③实验后溶液为等浓度的NaA、HA的混合液,NaA水解呈碱性、HA电离呈酸性,实验数据表明溶液呈酸性,混合溶液中HA的电离程度比NaA的水解程度强;
故答案为:强.
点评 本题考查弱电解质的电离,侧重考查学生分析判断能力,明确弱电解质电离特点及弱电解质电离影响因素是解本题关键,注意:酸影响水电离程度与氢离子浓度有关、与酸的强弱无关,为易错点.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:解答题
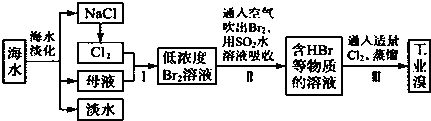
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
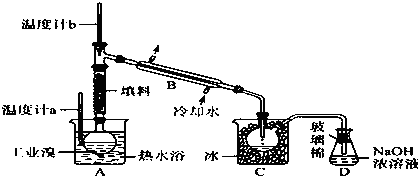
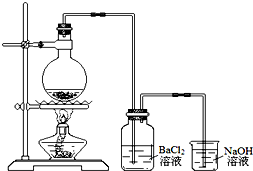 某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按如图所示装置进行实验.
某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按如图所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和氯水中 Br-、NO3-、Na+、SO32- | |
| B. | 由水电离出的C(H+)=1×10 -12 mol•L-1的溶液:K+、Ba2+、HCO3-、Cl- | |
| C. | 0.1 mol•L-1FeCl3溶液:K+、NH4+、NO3-、SO42- | |
| D. | c(H+)/c(OH-)=1×10 -12的溶液:Ca2+、Fe3+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C生成的速率与C分解的速率不相等 | |
| B. | A、B、C的浓度不再变化 | |
| C. | 单位时间生成nmolA,同时生成3nmolB | |
| D. | A、B、C的分子数之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | B. | c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | ||
| C. | c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | D. | c(Na+)+c(OH-)=c(CH3COO-)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
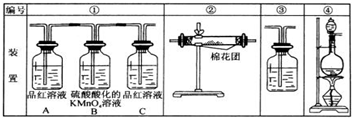
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com