
【题目】已知:5C2O42-+2MnO4-+16H+ = 2Mn2++10CO2↑+8H2O。某研究小组通过如下实验步骤测定晶体A(KxFey(C2O4)z·aH2O,其中的Fe元素为+3价)的化学式:
步骤1:准确称取A样品9.820 g,分为两等份;
步骤2:取其中一份,干燥脱水至恒重,残留物质量为4.370g;
步骤3:取另一份置于锥形瓶中,加入足量的3.000 mol·L-1 H2SO4溶液和适量蒸馏水,使用0.5000 mol·L-1 KMnO4溶液滴定,滴定终点消耗KMnO4溶液的体积为24.00 mL;
步骤4:将步骤1所得固体溶于水,加入铁粉0.2800 g,恰好完全反应。
通过计算确定晶体A的化学式(写出计算过程) _______________。
【答案】均分两份样品,则每份质量分别为![]() =4.910g,4.910 g样品A中,n(H2O)=
=4.910g,4.910 g样品A中,n(H2O)=![]() =0.0300mol。根据5C2O42-~2MnO4-得:n(C2O42-)=2.5×n(MnO4-)=2.5×0.5000 mol·L-1 ×0.02400 L=0.0300mol。又根据2Fe3++Fe=3Fe2+可得:n(Fe3+)=2×n(Fe)=
=0.0300mol。根据5C2O42-~2MnO4-得:n(C2O42-)=2.5×n(MnO4-)=2.5×0.5000 mol·L-1 ×0.02400 L=0.0300mol。又根据2Fe3++Fe=3Fe2+可得:n(Fe3+)=2×n(Fe)=![]() =0.0100mol。又因为电荷守恒:n(K+)+3n(Fe3+)≈2n(C2O42-),可得:n(K+)+3×0.0100mol=2×0.0300mol,解得:n(K+)=0.0300mol。所以,n(K+):n(Fe3+):n(C2O42-):n(H2O)=3:1:3:3,所以,A的化学式K3Fe(C2O4)3·3H2O。
=0.0100mol。又因为电荷守恒:n(K+)+3n(Fe3+)≈2n(C2O42-),可得:n(K+)+3×0.0100mol=2×0.0300mol,解得:n(K+)=0.0300mol。所以,n(K+):n(Fe3+):n(C2O42-):n(H2O)=3:1:3:3,所以,A的化学式K3Fe(C2O4)3·3H2O。
【解析】
均分两份样品,则每份质量分别为![]() =4.910g,4.910 g样品A中,n(H2O)=
=4.910g,4.910 g样品A中,n(H2O)=![]() =0.0300mol。根据5C2O42-~2MnO4-得:n(C2O42-)=2.5×n(MnO4-)=2.5×0.5000 mol·L-1 ×0.02400 L=0.0300mol。又根据2Fe3++Fe=3Fe2+可得:n(Fe3+)=2×n(Fe)=
=0.0300mol。根据5C2O42-~2MnO4-得:n(C2O42-)=2.5×n(MnO4-)=2.5×0.5000 mol·L-1 ×0.02400 L=0.0300mol。又根据2Fe3++Fe=3Fe2+可得:n(Fe3+)=2×n(Fe)=![]() =0.0100mol。忽略水的电离,根据电荷守恒:n(K+)+3n(Fe3+)≈2n(C2O42-),可得:n(K+)+3×0.0100mol=2×0.0300mol,解得:n(K+)=0.0300mol。所以,n(K+):n(Fe3+):n(C2O42-):n(H2O)=3:1:3:3,所以,A的化学式K3Fe(C2O4)3·3H2O。
=0.0100mol。忽略水的电离,根据电荷守恒:n(K+)+3n(Fe3+)≈2n(C2O42-),可得:n(K+)+3×0.0100mol=2×0.0300mol,解得:n(K+)=0.0300mol。所以,n(K+):n(Fe3+):n(C2O42-):n(H2O)=3:1:3:3,所以,A的化学式K3Fe(C2O4)3·3H2O。


科目:高中化学 来源: 题型:
【题目】短周期中8种元素a-h,其原子半径、最高正化合价或最低负化合价随原子序数递增的变化如图所示。
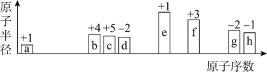
下列判断不正确的是
A.a、d、f组成的化合物能溶于强碱溶液
B.a可分别与b或c组成含10个电子的分子
C.e的阳离子与g的阴离子具有相同的电子层结构
D.最高价氧化物对应水化物的酸性:h>g>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】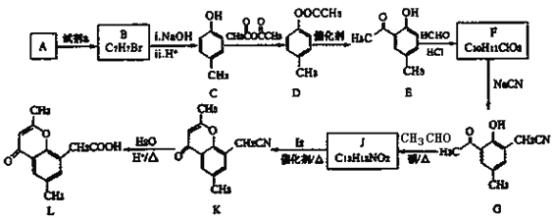
已知:①R-X![]() R-CN
R-CN![]() R-COOH
R-COOH
②R1CHO+CH3COR2![]() R1CH=CHCOR2
R1CH=CHCOR2
③![]()
(1)A 的分子式是 C7H8,写出 A→B 反应的化学方程式_____。
(2)写出 C→D 的化学方程式_____。
(3)E 与 HCHO 反应的反应类型为_____,写出 F 的结构简式_____。
(4)写出 D 与足量 NaOH 溶液反应的化学方程式____________。
(5)写出 J 与 I2 反应生成 K 和 HI 的化学方程式____________________。
(6)以 A 和乙烯为起始原料,结合题中信息,选用必要的无机试剂合成苯乙酸乙酯(![]() ),写出相应的合成路线_____________。
),写出相应的合成路线_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、W为常见的主族元素,根据下表信息回答问题:
元素 | 元素性质或原子结构信息 |
X | 短周期元素原子半径最大(稀有气体元素不参与比较) |
Y | +3价阳离子的核外电子排布与氖原子相同 |
Z | 原子核外M电子层与K电子层的电子数相等 |
R | 与Z同周期,主要化合价为1、+7 |
W | 原子结构示意图: |
(1)写出元素X的原子结构示意图_____;元素W在周期表中位置_____。
(2)Y、Z最高价氧化物对应水化物的碱性强弱比较_____>_____(填化学式)。
(3)用电子式表示X和R形成化合物的过程:_____。
(4)下列对于W及其化合物的推断中,正确的是_____(填序号)。
①W的最低负化合价与R的最低负化合价相同
②W的氢化物的稳定性弱于R的氢化物的稳定性
③W的单质可与X和R形成的化合物的水溶液发生置换反应
④W的最高价氧化物对应水化物的酸性比R的强
(5)为验证卤族部分元素单质氧化性的递变规律,设计如图装置进行实验,请回答:
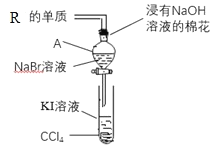
①A中发生的反应的离子方程式是_____。
②棉花中浸有的NaOH溶液的作用是_____(用离子方程式表示)。
③为验证Br2与I2的氧化性强弱:通入一定量R的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到_____。该实验必须控制加入的R单质的量,否则得不出Br2的氧化性比I2强。理由是______。
④从原子结构的角度解释卤族元素单质氧化性逐渐减弱的原因:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( )

A. 所含原子数相等 B. 气体密度相等C.气体质量相等 D.摩尔质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法错误的是( )

A.Z、Y、X的原子半径依次减小,非金属性依次降低
B.Z、Y、W的最高价氧化物的水化物的酸性依次降低
C.W与Y两种元素都存在多种同素异形体
D.Y的气态氢化物与Z的单质在一定条件下可发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为验证同主族元素非金属性的变化规律,设计了如下实验(实验装置如图所示)。
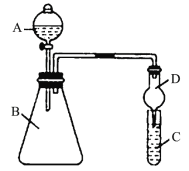
(1)仪器A的名称为___,干燥管D的作用是___。
(2)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为___。
(3)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4固体,C中加淀粉碘化钾混合溶液,观察到___,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用___溶液吸收尾气。
(4)课外活动小组在A中加盐酸、B中加CaCO3固体,C中加Na2SiO3溶液,观察到C中产生白色沉淀(H2SiO3),请你利用原子结构知识解释这一现象:___;有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加盛有___的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素![]() 、
、![]() 、
、![]() 、
、![]() 原子序数依次增大,
原子序数依次增大,![]() 与
与![]() 同主族但最高化合价不同,
同主族但最高化合价不同,![]() 是金属性最强的短周期元素。下列说法不正确的是( )。
是金属性最强的短周期元素。下列说法不正确的是( )。
A.简单离子半径:![]()
B.最高价氧化物对应水化物的酸性:![]()
C.化合物![]() 能与水剧烈反应,产生白雾并放出具有刺激性气味的气体
能与水剧烈反应,产生白雾并放出具有刺激性气味的气体
D.![]() 的气态氢化物通入
的气态氢化物通入![]() 水溶液中产生淡黄色沉淀并放出有刺激性气味的气体
水溶液中产生淡黄色沉淀并放出有刺激性气味的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势如图所示:
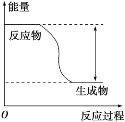
(1)该反应为_____(填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率加快,下列措施可行的是_____(填字母)。
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为_____(填“正”或“负”)极。铜片上的现象为_____,该极上发生的电极反应为_____,外电路中电子由_____移动。(填“正极向负极”或“负极向正极”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com