
分析 pH=8时,c(OH-)=10-6mol/L,可结合两种物质的溶解度常数分别计算c(Mg2+)、c(Fe3+),进而计算比值.
解答 解:根据氢氧化镁和氢氧化铁的溶解平衡以及溶度积表达式,则当两种沉淀共存且溶液的pH=8时,c(OH-)=10-6mol/L,
c(Mg2+)=$\frac{K{\;}_{sp}}{c(OH{\;}^{-}){\;}^{2}}$=$\frac{5.61×10{\;}^{-12}}{10{\;}^{-12}}$═5.61mol/L,
c(Fe3+)=$\frac{K{\;}_{sp}}{c(OH{\;}^{-})^{3}}$=$\frac{2.64×10{\;}^{-39}}{10{\;}^{-18}}$=2.64×10-21mol/L,
所以 c(Mg2+):c(Fe3+)=5.61:2:64×10-21=2.215×1021;
故答案为:2.215×1021.
点评 本题考查难溶电解质的溶解平衡知识,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意根据溶度积常数计算并进行判断,答题中注意梳理做题思路.


科目:高中化学 来源: 题型:选择题
| A. | 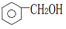 醇类-OH 醇类-OH | B. | CH3CH2COOH 羧酸类-COOH | ||
| C. | 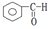 酮类-CHO 酮类-CHO | D. | CH3CH2Br 卤代烃类-Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验自来水中是否含Cl- | B. | 检验鸡蛋壳(CaCO3)能否溶于酸 | ||
| C. | 鉴别AgNO3 溶液和BaCl2 溶液 | D. | 除去热水瓶内壁上的水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积不变充入惰性气体,反应速率增大 | |
| B. | 其他条件不变,降低温度,平衡转化率一定变化 | |
| C. | 其他条件不变时,增大压强,平衡左移,平衡常数K减小 | |
| D. | 若增加或减少A物质的量,反应速率一定会发生明显的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ksp(AB2)小于Ksp(CD),则化合物AB2的溶解度一定小于化合物CD的溶解度 | |
| B. | 在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的溶解度增大 | |
| C. | 在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀 | |
| D. | 在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ksp只与难溶电解质的性质和温度有关 | |
| B. | 由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 | |
| C. | 难溶电解质Mg(OH)2的Ksp=c( Mg2+)•c(OH-) | |
| D. | 25℃,Ksp(AgCl)=1.8×10-10,则AgCl饱和水溶液体系中c(Ag+)为$\sqrt{1.8}$×10-5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | FeS的Ksp小于CuS的Ksp | |
| B. | 达到平衡时c(Fe2+)=c(Cu2+) | |
| C. | 溶液中加入少量 Na2S固体后,溶液中c (Cu2+)、c (Fe2+)都减小 | |
| D. | 该反应平衡常数 K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(CuS)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
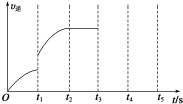 一定温度下在体积为5L的密闭容器中发生可逆反应.
一定温度下在体积为5L的密闭容器中发生可逆反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com