
【题目】研究化学反应时,既要考虑物质变化与能量变化,又要关注反应的快慢与限度。回答下列问题:
(1)NH3还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图所示

①上图中因为改变了反应条件,反应的活化能:b_______(填“>”“<"或“=”)a。
②脱硝反应的热化学方程式可表示为反应物→生成物△H=______(用E1、E2的代数式表示)。
③研究发现,一定条件下的脱硝反应过程可能如图所示,根据氧化还原反应中物质的作用,NO为_______剂,脱硝总反应的化学方程式为_______________。

(2)一定温度下,将不同物质的量的H2O(g)和CO分别通入容积为1L的恒容密容器中,进行反应H2O(g)+CO(g)![]() CO2(g)+H2(g),得到如表所示的三组数据
CO2(g)+H2(g),得到如表所示的三组数据
试验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡时间/min | ||
H2O(g) | CO(g) | CO(g) | H2(g) | |||
1 | 650 | 2.0 | 4.0 | 3.0 | 1.0 | 5 |
2 | 900 | 1.0 | 2.0 | 1.8 | 0.2 | 4 |
3 | 900 | a | b | c | d | t |
①4mim内,实验2中v(CO2)=______; 900℃时,反应的平衡常数为______;降低温度时,平衡常数会________(填“增大”“减小”或“不变”)。
②650℃时,若在此容器中充入2.0 mol H2O(g)、1.0molCO(g)、1.0 mol CO2(g)和 xmol H2(g),要使反应在开始时向正反应方向进行,则x应满足的条件是__________。
若a=2.0.b=1.0,则平衡时实验2中H2O(g)和实验3中CO(g)的转化率(a)的关系为a(H2O) _______ (填“>”<”成=”)a(CO)。
【答案】< -(E2-E1) 还原 4NH3+4NO+O2![]() 4N2+6H2O 0.05mol/L-1·min-1
4N2+6H2O 0.05mol/L-1·min-1 ![]() 增大 0≤x<
增大 0≤x<![]() =
=
【解析】
(1)①催化剂可降低反应活化能;
②E1是正反应活化能,E2是逆反应活化能,正反应△H=正反应活化能-逆反应活化能;
③根据化合价去分析氧化剂、还原剂以及氧化还原方程式配平;
(2)①反应速率公式![]() ,再根据速率比等于化学计量数之比求答;根据1,2组数据,求出平衡常数,找出平衡常数与温度的关系;
,再根据速率比等于化学计量数之比求答;根据1,2组数据,求出平衡常数,找出平衡常数与温度的关系;
②平衡常数计算中代入的必然是平衡时的浓度,而浓度商则不一定是平衡时的浓度。浓度商小于平衡常数时反应向右进行,等于平衡常数时达平衡,大于平衡常数时反应向左进行。
③分别列出三段式比较进行分析。
(1)①由图像可知活化能降低,故答案应为:<;
②由图,反应物能量大于生成物能量,故反应是放热反应,用-表示放热,△H=正反应活化能-逆反应活化能,故答案应为:-(E2-E1);
③NO在反应中化合价降低,作氧化剂;由图2可知反应物为NH3、NO和O2,生成物为N2和H2O,所以化学方程式为4NH3+4NO+O2![]() 4N2+6H2O,故答案应为:氧化;4NH3+4NO+O2
4N2+6H2O,故答案应为:氧化;4NH3+4NO+O2![]() 4N2+6H2O;
4N2+6H2O;
(2)①由方程式可知v(CO2):v(H2)=1:1,根据图表计算v(H2)=0.2mol/L÷4min=0.05mol/L-1·min-1,故v(CO2)=0.05mol/L-1·min-1,根据平衡常数计算公式,900℃平衡常数为![]()
![]() ,同理可计算650℃平衡常数为
,同理可计算650℃平衡常数为![]() ,故降低温度平衡常数增大。故答案应为:0.05mol/L-1·min-1;
,故降低温度平衡常数增大。故答案应为:0.05mol/L-1·min-1;![]() ;增大;
;增大;
②计算此时此刻的![]() ,化学平衡正向移动,所以Q<平衡常数k,所以
,化学平衡正向移动,所以Q<平衡常数k,所以![]() ,
,![]() ,由题x应≥0。故答案应为:0≤x<
,由题x应≥0。故答案应为:0≤x<![]() ;
;
③根据平衡常数和三段式分别求出实验2中H2O(g)的转化率为20%。实验3中CO(g)的转化率为y,则
H2O(g)+CO(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L) 2 1 0 0
转化浓度(mol/L/span>) y y y y
平衡浓度(mol/L)2-y 1-y y y
则![]()
解得y=0.2
即实验3中CO(g)的转化率为20%。故答案应为:=。


科目:高中化学 来源: 题型:
【题目】化合物W是药物合成的中间体,它的一种合成路线如下:

回答下列问题:
(1)试剂a是___________。
(2)A的名称是___________;F中官能团的名称是___________。
(3)下列说法正确的是___________(填正确选项编号)。
a.CH2= CHCHO不存在顺反异构体 b.D能发生水解反应
c.E的分子式为C9H14NO2 d.⑧发生了还原反应
(4)反应③的化学方程式是___________。
(5)G(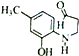 )有多种同分异构体。属于丁酸酯且苯环上含一NH2的同分异构体有___________种,其中核磁共振氢谱显示为6组峰,且峰面积之比为3:2:2:2:2:2的结构简式为___________。
)有多种同分异构体。属于丁酸酯且苯环上含一NH2的同分异构体有___________种,其中核磁共振氢谱显示为6组峰,且峰面积之比为3:2:2:2:2:2的结构简式为___________。
(6)  是制药中间体,结合题中流程和已学知识设计由D为起始原料合成
是制药中间体,结合题中流程和已学知识设计由D为起始原料合成 的合成路线图:___________(无机试剂任选)。
的合成路线图:___________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据组成原电池的条件,试以反应:Fe+Cu2+=Fe2++Cu设计一个原电池,画出示意图并标出原电池的正、负极和电子的流向(画在方框中)。_________________
供选用的电解质溶液有:稀硫酸、硫酸铜溶液
供选用的电极材料有:锌片、铜片、铁片
电极材料及电极反应式:
负极材料:______________,电极反应式:___________________,
正极材料:______________,电极反应式:___________________,
电解质溶液:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜的配合物A结构如图。请回答下列问题:

(1)写出基态Cu的外围电子排布式_____________________________________。
(2)配体氨基乙酸根(H2NCH2COOˉ)受热分解可产生CO2和N2,N2中σ键和π键数目之比是__________;N2O与CO2互为等电子体,则N2O的电子式为____________。
(3)在Cu催化下,甲醇可被氧化为甲醛,甲醛分子中HCO的键角_____(选填“大于”、“等于”或“小于”)120°;甲醛能与水形成氢键,请在如图中表示出来_____。

(4)立方氮化硼如图与金刚石结构相似,是超硬材料。立方氮化硼晶体内B-N键数与硼原子数之比为___________;

(5)Cu晶体的堆积方式如图所示,设Cu原子半径为a,晶体中Cu原子的配位数为________,晶体的空间利用率为______。(已知:![]() ,列式并计算出结果)
,列式并计算出结果)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,HNO2的电离平衡常数为K=4.6×10-4(已知![]() 2.14),向20mL0.01molL-1HNO2溶液中逐滴加入相同浓度的NOH溶液,测得混合液的 pH随NaOH溶液体积的变化如图所示,下列判断正确的是
2.14),向20mL0.01molL-1HNO2溶液中逐滴加入相同浓度的NOH溶液,测得混合液的 pH随NaOH溶液体积的变化如图所示,下列判断正确的是

A. X=20
B. a、b、c、d四点对应的溶液中水的电离程度逐渐减小
C. a点溶液中c(H-)=2.14×10-3molL-1
D. b点溶液中微粒浓度的大小关系为c(HNO2)>c(Na+)>c(NO2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子树脂具有较好的吸水性,其合成线路如下:

已知:I:-CHO+-CH2CHO![]() -CH=CHCHO
-CH=CHCHO
II. -CH=CH-COOH
-CH=CH-COOH
回答下列问题
(1)G中的含氧官能团名称为______,M的结构简式为_______。
(2)由A生成B的化学方程式为______________________。
(3)上述合成路线中,D→E的转化在合成M中的作用为_________________。
(4)下列选项中对有机物F的性质推测正确的是_______________________。(填字母)
A. 1mol F与足量NaHCO3溶液反应放出2molCO2
B. 能发生水解反应和消去反应
C. 能聚合成高分子化合物
D. 1 mol F最多消耗3 mol NaOH
(5)符合下列条件的G的同分异构体有________种
A.属于芳香族化合物,且只有1种官能团
B.能发生银镜反应
C.除苯环外不存在其他环状结构
其中核磁共振氢谐有4组峰的是________(写出其中一种的结构简式)
(6)根据上述合成路线和信息,以苯乙醛为原料(其他无机试剂任选)设计制备 的合成路线______
的合成路线______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对伞花烃(图I)常用作染料、医药、香料的中间体。下列说法错误的是
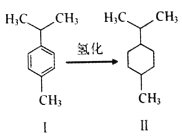
A. 常温对伞花烃呈液态且难溶于水
B. 图Ⅱ物质的一氯代物有5种结构
C. 对伞花烃最多有9个碳原子共平面
D. 图中氢化反应既是加成反应又是还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将同温同压下的H2、O2、Cl2按13:6:1的体积比混合,在密闭容器中用电火花引燃,充分反应后使产物冷却液化,所得溶液的质量分数是( )
A.33.6%B.25.3%C.16.8%D.14.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g) + bB(g)![]() xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指( )
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指( )

A.反应物A的百分含量
B.平衡混合气中物质B的百分含量
C.平衡混合气的密度
D.平衡混合气的平均摩尔质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com