
| A. | 2N2(g)+O2(g)═2N2O(g)△H=+163 kJ•mol-1 | |
| B. | 2Ag(s)+Cl2(g)═2AgCl(s)△H=-127 kJ•mol-1 | |
| C. | 2HgO(s)═2Hg(l)+O2(g)△H=+91 kJ•mol-1 | |
| D. | 2H2O2(l)═O2(g)+2H2O(l)△H=-98 kJ•mol-1 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AlCl3溶液中加入过量浓氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 向澄清石灰水中通入少量CO2:OH-+CO2═HCO3- | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | NH4HCO3溶于过量的浓KOH溶液中:NH4++OH-═NH3•H2O |
查看答案和解析>>
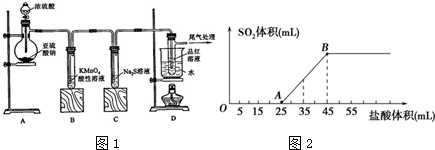
科目:高中化学 来源: 题型:解答题
 .
. .
.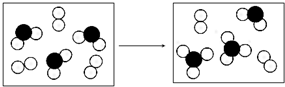
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④>①>③>② | B. | ①>④>③>② | C. | ①=④>③=② | D. | ④=①>③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.00mol NaCl中含有6.02×1023个NaCl分子 | |
| B. | 欲配制1.00 L 1.00mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 | |
| C. | 1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023 | |
| D. | 电解58.5g 熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0g金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠常温下与氧气反应生成Na2O,升高温度生成 Na2O的速率加快 | |
| B. | 常温下,铜与稀硝酸反应生成NO,增大硝酸的浓度,生成NO的速率加快 | |
| C. | 锌与稀硫酸制备氢气,加入少量的硫酸铜溶液,生成H2的速率加快 | |
| D. | 对密闭容器中发生的反应2NO2?2NO+O2 缩小体积,增大压强,V(正)减小,V(逆)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6L O2作氧化剂时转移电子数一定为NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 已知3BrF3+5H2O═HBrO3+Br2+9HF+O2↑如果有5molH2O参加氧化还原反应,则由水还原的BrF3分子数目为3NA | |
| D. | 142gNa2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com