
| c(Cl-) |
| c(ClO-) |
A、若某温度下,反应后C(Cl-):C(ClO-)=11,则溶液中C(ClO-):C(ClO3-)=
| ||||
B、参加反应的氯气的物质的量等于
| ||||
C、改变温度,反应中转移电子的物质的量n的范围:
| ||||
D、改变温度,产物中KC1O3的最大理论产量为
|
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 6 |
| 1 |
| 6 |
| 1 |
| 6 |
| 5 |
| 6 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 5 |
| 6 |
| 1 |
| 6 |
| 1 |
| 6 |


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:
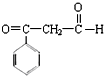 是一种重要的化工原料.A、B、C、D、E之间的转化关系如图:
是一种重要的化工原料.A、B、C、D、E之间的转化关系如图: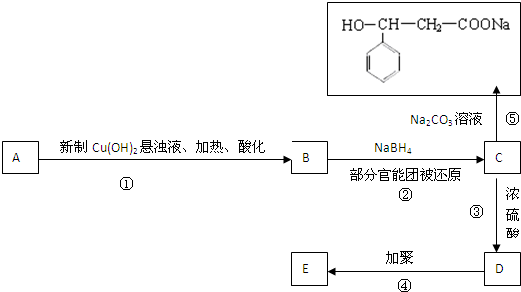
查看答案和解析>>
科目:高中化学 来源: 题型:
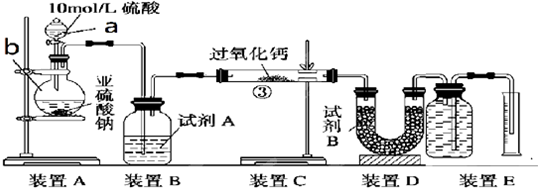
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该烷烃的物质的量为(b-a)mol |
| B、该烷烃的物质的量为a mol |
| C、该烷烃的物质的量为(b-a)/2 mol |
| D、不能求出该烷烃的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Cl-、SO42- |
| B、SO42-、Ca2+、CO32- |
| C、H+、CO32-、Cl- |
| D、Fe3+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O |
| B、碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3-+2OH-═CO32-+NH3?H2O+H2O |
| C、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| D、Ca(HCO3)2溶液中加入少量的NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某浓度的醋酸钠溶液滴入几滴酚酞试液:溶液由无色变为浅红色 |
| B、向滴有甲基橙试液的醋酸溶液加入少量醋酸钠晶体:振荡后溶液由红色变为橙色 |
| C、通过对比不同浓度的导电实验:醋酸溶液的导电性较盐酸溶液的导电性弱 |
| D、取相同体积pH=1的盐酸和醋酸溶液,分别加入足量的锌,用排水法收集生成的氢气:相同条件下,醋酸生成的氢气体积大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com