
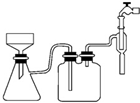
 阿司匹林口服时,具有解热镇痛作用,是一种常用的治疗感冒的药物,也可用于抗风湿,促进痛风患者尿酸的排泄.近年来还发现阿司匹林能抑制血小板凝聚,可防止血栓的生成;它的有效成分是乙酰水杨酸(
阿司匹林口服时,具有解热镇痛作用,是一种常用的治疗感冒的药物,也可用于抗风湿,促进痛风患者尿酸的排泄.近年来还发现阿司匹林能抑制血小板凝聚,可防止血栓的生成;它的有效成分是乙酰水杨酸( ).
).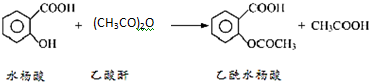

分析 醋酸酐和水杨酸混合,然后向混合溶液中加入浓硫酸,相当于浓硫酸的稀释,并不断搅拌,防止局部受热而产生安全事故;摇匀后加热至85℃,然后冷却、过滤、水洗得到粗产品,然后向粗产品中加入饱和碳酸氢钠溶液,使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,从而除去杂质;然后用浓盐酸洗涤剩余的碳酸氢钠、将乙酰水杨酸钠转化为乙酰水杨酸,最后过滤、洗涤、干燥得到乙酰水杨酸;
(1)温度低于100℃时采用水浴加热;
(2)用图装置过滤比普通漏斗过滤,其优点是过滤速度快、得到的产品较干燥;
(3)①使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,乙酰水杨酸钠易溶于水;
②加浓盐酸、冷却后的操作是过滤、洗涤;
③酚羟基能和氯化铁发生显色反应;
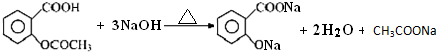
(4)根据题意计算乙酰水杨酸消耗的氢氧化钠的物质的量,结合乙酰水杨酸的物质的量是消耗的氢氧化钠的物质的量的$\frac{1}{3}$,可以得到阿司匹林药片中乙酰水杨酸质量分数.
解答 解:醋酸酐和水杨酸混合,然后向混合溶液中加入浓硫酸,相当于浓硫酸的稀释,并不断搅拌,防止局部受热而产生安全事故;摇匀后加热至85℃,然后冷却、过滤、水洗得到粗产品,然后向粗产品中加入饱和碳酸氢钠溶液,使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,从而除去杂质;然后用浓盐酸洗涤剩余的碳酸氢钠、将乙酰水杨酸钠转化为乙酰水杨酸,最后过滤、洗涤、干燥得到乙酰水杨酸;
(1)温度低于100℃时采用水浴加热,该操作中温度小于100℃,所以需要水浴加热,
故答案为:水浴加热;
(2)用图装置过滤比普通漏斗过滤,其优点是过滤速度快、得到的产品较干燥,
故答案为:过滤速度快、得到的产品较干燥;
(3)①使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,乙酰水杨酸钠易溶于水,从而除去杂质,且便于分离;乙酰水杨酸能和碳酸氢钠反应生成二氧化碳气体,所以判断该过程结束的现象是没有气体(CO2)产生;
故答案为:使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,便于与杂质分离;没有气体(CO2)产生;
②加浓盐酸、冷却后的操作是过滤、洗涤、干燥,从而得到较纯净、干燥的物质,
故答案为:过滤;洗涤;
③酚羟基能和氯化铁发生显色反应,加入氯化铁溶液后混合溶液呈紫色,说明产品中仍然可能含有水杨酸,
故答案为:产品中仍然可能含有水杨酸;
(4)乙酰水杨酸消耗的氢氧化钠的物质的量为:aV1×10-3-bV2×10-3,乙酰水杨酸的物质的量是消耗的氢氧化钠的物质的量的$\frac{1}{3}$,阿司匹林药片中乙酰水杨酸质量分数的表达式为$\frac{0.180(a{V}_{1}-b{V}_{2})}{3m}$,故答案为:$\frac{0.180(a{V}_{1}-b{V}_{2})}{3m}$.
点评 本题考查物质制备,为高频考点,明确实验原理、实验操作方法、实验先后顺序是解本题关键,知道每一步可能发生的反应、基本操作方法,知道物质分离提纯方法与物质性质关系,题目难度不大.


科目:高中化学 来源: 题型:填空题

| 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | |
| 四氯化锡 | 2.2 | -33 | 114 |
| 金属锡 | 5.77 | 231 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 间二甲苯的二氯代物有5种 | |
| B. | 二氯甲烷有2种同分异构体 | |
| C. | 丙烯分子中所有的原子有可能在同一平面上 | |
| D. | 用-C4H9取代苯环上的1个氢原子,最多可得4种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④②⑤③ | B. | ⑤②①④③ | C. | ②⑤④①③ | D. | ④①②⑤③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲:NaOH; 乙:稀盐酸 | B. | 甲:水; 乙:氢氧化钠溶液 | ||
| C. | 甲:氢氧化钠溶液; 乙:水 | D. | 甲:稀盐酸; 乙:氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉胶体加入电解质可发生聚沉现象 | |
| B. | 向Fe(OH)3胶体中加入少量H2SO4溶液,会生成红褐色沉淀 | |
| C. | 可利用丁达尔效应区分胶体与溶液 | |
| D. | 胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅①和④ | B. | 仅①和③ | C. | 仅②和③ | D. | 仅②和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | Ⅰ | Ⅱ |
| 实验一 |   |  |
| 编号 | Ⅲ | |
| 实验二 |  | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 北京时问2015年10月5日,中国女科学家屠哟哟获颁诺贝尔医学奖.屠哟哟从中医古籍里得到启发,用乙醚从青蒿中提取出可以高效抑制疟原虫的成分-青蒿素(结构简式如图),这一发现在全球范围内挽救了数以百万人的生命.下列说法中不正确的是( )
北京时问2015年10月5日,中国女科学家屠哟哟获颁诺贝尔医学奖.屠哟哟从中医古籍里得到启发,用乙醚从青蒿中提取出可以高效抑制疟原虫的成分-青蒿素(结构简式如图),这一发现在全球范围内挽救了数以百万人的生命.下列说法中不正确的是( )| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素能与NaOH溶液反应 | |
| C. | 青蒿素易溶于水、乙醇、苯等溶剂 | |
| D. | 用乙醚从青蒿中提取青蒿素,用到了萃取的原理 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com