
【题目】CO2和CH4是两种重要的温室气体,通过CH4和CO2的反应,制造更高价值的化学品是目前的研究目标。250℃时,以镍合金为催化剂,发生如下反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
(1)此温度下该反应的平衡常数表达式K=___;
(2)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H=-890.3kJmol-1
②CO(g)+H2O(g)═CO2(g)+H2(g) △H=+2.8kJmol-1
③2CO(g)+O2(g)═2CO2(g) △H=-566.0kJmol-1
反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的△H=___kJmol-1。
2CO(g)+2H2(g)的△H=___kJmol-1。
【答案】![]() +247.3kJmol-1
+247.3kJmol-1
【解析】
:
(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则CO2(g)+CH4(g)2CO(g)+2H2(g)的平衡常数表达式为K= ![]() ;
;
故答案为![]() 。
。
(2)已知CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJmol-1 ①
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=+2.8kJmol-1 ②
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJmol-1 ③
根据盖斯定律,由①+②×2-③×2得,CO2(g)+CH4(g)2CO(g)+2H2(g)△H=-890.3kJmol-1+2.8kJmol-1×2+566.0kJmol-1×2=+247.3 kJmol-1;
答案为+247.3 kJmol-1。![]()


科目:高中化学 来源: 题型:
【题目】连二亚硫酸盐(如ZnS2O4)在工业中用作漂白剂、解毒剂、吸氧剂等,用途十分广泛。
Ⅰ.制取ZnS2O4溶液和晶体
控制3545℃进行反应,原理为:Zn+2SO2=ZnS2O4。
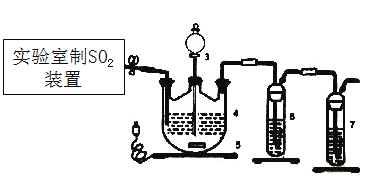
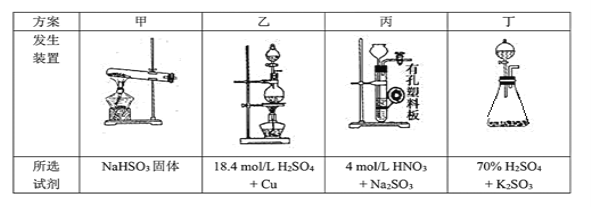
(1)下列四种制备SO2的方案中最佳选择是___________。
(2)停止电加热,仪器3放入一定量乙醇,制得ZnS2O4晶体,主要原因是_________。
Ⅱ.测定产率
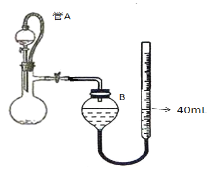
(3)仪器4中加入mg锌粉与一定量的水,电加热并启动磁力搅拌器5。一段时间后,待固体物质完全消失时,关闭活塞和止水夹。取ZnS2O4晶体的十分之一放于真空容器中,加适量的水、通适量氧气使其恰好转化为Zn(HSO4)2和Zn(HSO3)2固体,然后加入足量的硫酸,通过测定生成气体的体积来求算ZnS2O4晶体的产率。请回答下列相关问题:
①测定装置中,导管A的作用:一是________;二是________。
②为提高测定的准确度,仪器B中最宜选用_____________。
A.饱和食盐水 B.饱和NaHSO3溶液 C. 饱和澄清石灰水 D.98.3%的浓硫酸
③用图中量气管读数为起点,若终点读数为17.60mL,且实验温度下气体摩尔体积为VmL.mol-1,可得出ZnS2O4的产率为 ____________%。
(4)如果反应温度超过45℃,会导致ZnS2O4分解,仪器4中有黄色沉淀、白色沉淀且伴随着气泡生成,则ZnS2O4分解的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了9种元素在周期表中位置,用化学符号回答下列问题。
周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | E | F | ||||||
3 | A | C | D | G | R | |||
4 | B | H |
(1)这九种元素中:化学性质最不活泼的是__;金属性最强的是:__,最高价氧化物的水化物酸性最强的酸是__,最高价氧化物的水化物碱性最强的碱的电子式__。
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应的水化物反应的离子方程式是__。
(3)A、B、C三种元素按离子半径由大到小的顺序排列为__。
(4)F的最常见氢化物的电子式__;该氢化物在常温下跟B发生反应的化学方程式是__。
(5)C元素跟G元素形成的化合物的电子式是__,用电子式表示其形成过程为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芜湖市某便利店销售的一种食用碘盐包装袋上有如下标签:
产品标准 | GB5461 |
产品等级 | 一级 |
配料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,请配平化学方程式:____KIO3+____KI+____H2SO4=____K2SO4+_____I2+____H2O
(2)实验室可分离获取单质碘,其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把适量碘水和CCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口玻璃塞是否漏液;
D.倒转漏斗,用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.从分液漏斗的上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开;
H.静置、分层;
①正确的操作顺序是(用编号字母填写)____→____ → ___→A → __→ ___→E→F。
②下列物质,不能作为从水溶液中萃取碘的溶剂是____。
A.苯 B.汽油 C.酒精
(3)若向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。理论上Na2SO3与I2反应的物质的量之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用呋喃甲醛为原料制备呋喃甲醇与呋喃甲酸。
Ⅰ、制备原理:
2![]() +NaOH
+NaOH![]() +
+![]()
![]() +HCl
+HCl![]() +NaCl
+NaCl
Ⅱ、实验步骤

Ⅲ、相关信息
呋喃甲醛 | 呋喃甲醇 | 呋喃甲酸 | 乙醚 | |
熔点/℃ | -36.5 | -29 | 133 | -116.3 |
沸点/℃ | 161.7 | 170 | 231 | 34.5 |
水溶性 | 微溶 | 微溶 | 可溶 | 不溶 |
相对分子质量 | 96 | 98 | 112 | 74 |
Ⅳ、实验装置


V、分析与思考,回答下列问题:
(1)操作①名称___;产品Y为___。
(2)操作②的装置如图1所示,收集产品X时温度计的读数应控制在90℃左右,其原因是___。
(3)操作①所得水溶液,加盐酸须控制pH为2~3,pH<3的理由是___;控制溶液pH时,应选择的指示剂是__。
(4)粗产品Y纯化过程用图2装置进行热过滤,具体操作:向铜漏斗中加热水→___→拆装置。涉及操作顺序最合理的选项。
A.加热漏斗支管→放入短颈漏斗→放入滤纸→放接液烧杯→倒入热的待滤液
B.放入短颈漏斗→放接液烧杯→加热漏斗支管→放入滤纸→倒入热的待滤液
C.放入短颈漏斗→放入滤纸→加热漏斗支管→放接液烧杯→倒入热的待滤液
D.放入短颈漏斗→放入滤纸→放接液烧杯→倒入热的待滤液→加热漏斗支管
(5)共消耗30mL萃取剂乙醚,从萃取效果角度思考,下列4种萃取方式最合理的是__。
A.30mL、0mL、0mL B.10mL、10mL、10mL
C.15mL、10mL、5 mL D.5mL、10mL、15mL
(6)计算产品Y的产率ω(Y)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究有机物A 的组成与结构,某同学进行如下实验。
i.0.2 molA 在氧气中完全燃烧后,生成CO2 和H2O 各 0.6 mol。
ii.通过质谱法测得其相对分子质量为 90。
iii.通过红外光谱法测得A 中含有—OH 和—COOH。
iv.A 的核磁共振氢谱图显示四组峰,峰面积之比为 1:1:1:3。
请回答下列问题。
(1)A 的分子式是_____。
(2)A 的结构简式是_____。
(3)已知:RCH2CH2OH![]() RCH=CH2 + H2O,在一定条件下,A有如下转化关系:A
RCH=CH2 + H2O,在一定条件下,A有如下转化关系:A![]() B
B![]() C其中,C是高分子物质,则A转化为B的化学方程式是:_____。C 的结构简式是:_____。
C其中,C是高分子物质,则A转化为B的化学方程式是:_____。C 的结构简式是:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
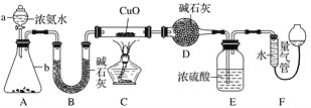
(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近意大利罗马大学的科学家获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N≡N放出942 kJ热量,根据以上信息和数据,下列说法正确的是

A.N4属于一种新型的化合物
B.N4与N2互称为同位素
C.N4沸点比P4(白磷)高
D.1 mol N4气体转变为N2将放出882 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使SO42-与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图所示。下列说法正确的是( )
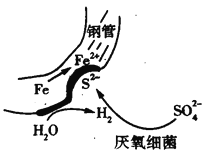
A. 正极的电极反应式为:2H2O+O2+4e-=4OH-
B. SO42-与H2的反应可表示为:4H2+SO42--8e S2-+4H2O
S2-+4H2O
C. 钢管腐蚀的直接产物中含有FeS、Fe(OH)2
D. 在钢管表面镀锌或铜可减缓钢管的腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com