
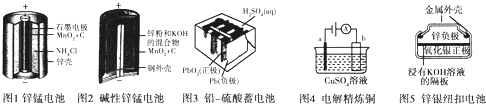
分析 (1)氯化氨溶液中铵根离子水解显示酸性,金属锌可以和酸之间反应;
(2)碱性锌锰电池的负极是Zn失电子生成Zn(OH)2;
(3)铅蓄电池工作时,硫酸参加反应生成硫酸铅同时生成水,导致硫酸浓度降低,该电池充电时阳极电极反应式与原电池正极反应式相反;
(4)a为阴极,电解精炼时纯铜接阴极;锌银纽扣电池在工作时,氧化银中银元素价态降低,被还原.
解答 解:(1)氯化氨溶液中铵根离子水解显示酸性,金属锌可以和酸之间反应:NH4++H2O?NH3•H2O+H+,故答案为:NH4++H2O?NH3•H2O+H+;
(2)负极发生氧化反应,由方程式可知Zn被氧化生成Zn(OH)2,则电极方程式为Zn+2OHˉ-2eˉ=Zn(OH)2,故答案为:Zn+2OH--2eˉ=Zn(OH)2;
(3)铅蓄电池工作时,硫酸参加反应生成硫酸铅同时生成水,导致硫酸浓度降低;该电池充电时阳极电极反应式与原电池正极反应式相反,电极反应式为2H2O+PbSO4+2e-=PbO2+SO42-+4H+,充电过程中,阳极附近c(SO42-)浓度将变大,故答案为:变大;PbSO4+2e-=Pb+SO42-;
(4)a为阴极,电解精炼时纯铜接阴极;锌银纽扣电池在工作时,氧化银中银元素价态降低,被还原,故答案为:纯铜;氧化银.
点评 本题考查了常见化学电源,注意原电池和电解池工作原理的应用是关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | +2 | B. | +3 | C. | +4 | D. | +5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体是澄清透明的 | B. | 胶体能产生丁达尔现象 | ||
| C. | 分散质粒子直径在1nm~100nm之间 | D. | 胶体在一定条件下能稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2+O2═2H2O△H=-142.9 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l)△H=-142.9 kJ/mol | ||
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | D. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | C>A>B>D | C. | A>C>D>B | D. | B>D>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 金属 | Na | Cu | Al | Fe |
| 熔点/℃ | 97.5 | 1083 | 660 | 1535 |
| 沸点/℃ | 883 | 2595 | 2200 | 3000 |
| A. | Cu与Al | B. | Fe与Cu | C. | Fe与Na | D. | Al与Na |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请完成下列各题
请完成下列各题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ | B. | K+ | C. | SO32- | D. | HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com