
| A. | 483.6 kJ•mol-1 | B. | 241.8 kJ•mol-1 | C. | 571.6 kJ•mol-1 | D. | 285.8 kJ•mol-1 |
分析 燃烧热是1mol可燃物质完全燃烧生成稳定氧化物放出的热量,所以氢生成液态水,而2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1可知,1mol氢气放出的热量,由此分析解答.
解答 解:燃烧热是1mol可燃物质完全燃烧生成稳定氧化物放出的热量,所以氢生成液态水,而2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1可知,1mol氢气的燃烧热是$\frac{571.6}{2}$=285.8 kJ•mol-1,所以氢气的燃烧热是285.8 kJ•mol-1,故选D.
点评 本题考查了燃烧热的概念,学生要了解燃烧热的定义,理解概念是解答的关键,题目较简单.


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:解答题
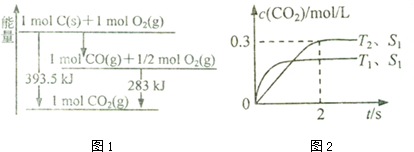
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H20)/mol | 0.60 | 0.50 | 0.44 | 0.40 | 0.40 |
| n(CO)/mol | 0.40 | 0.30 | 0.24 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 变化过程 | 现象 |
| A | 将少量酚酞滴加到过氧化钠固体上 | 变红 |
| B | 将过量氯气通入紫色石蕊试液中 | 褪色 |
| C | 过量氨水逐滴加入氯化铝溶液中 | 先产生白色沉淀后白色沉淀消失 |
| D | 氢氧化铁胶体中加入过量稀硫酸 | 先产生红褐色沉淀后溶解,溶液变为黄色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇的结构简式为CH3CH2OH,分子式为C2H5OH | |
| B. | 乙酸的电离方程式为CH3COOH=CH3COO-+H+ | |
| C. | 中子数为16的磷原子可表示为${\;}_{15}^{31}$P | |
| D. | S2-结构示意图为 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维是信息社会必不可少的有机合成材料 | |
| B. | 棉布、羊毛和涤纶燃烧后都只生成二氧化碳和水 | |
| C. | 储热材料是一类重要的能量存储物质,单位质量的储热材料在发生熔融或结晶时会吸收或释放较多的热量 | |
| D. | 煤经过气化和液化等物理变化可转化为清洁燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3与足量Ca(OH)2的反应:2HCO3-+Ca2++2OH-═CaCO3↓+CO${\;}_{{3}_{\;}^{\;}}^{2-}$+2H2O | |
| B. | 少量Na投入冷水中;Na+2H2O═Na++OH-+H2↑ | |
| C. | CuSO4与Ba(OH)2的反应:Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓ | |
| D. | AlCl3溶液中加入足量氨水:Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com