
【题目】在新制的氯水中存在平衡:Cl2+H2O ![]() H++Cl-+HClO,若向氯水中投入少量碳酸钙粉末,溶液中发生的变化是( )
H++Cl-+HClO,若向氯水中投入少量碳酸钙粉末,溶液中发生的变化是( )
A.H+浓度减小,HClO浓度减小
B.H+浓度增大,HClO浓度增大
C.H+浓度减小,HClO浓度增大
D.H+浓度增大,HClO浓度减小
【答案】C
【解析】碳酸的酸性弱于盐酸而强于次氯酸,向氯水中投入少量碳酸钙粉末后,它与盐酸反应,而不与次氯酸反应。又由于H+浓度减小,平衡Cl2+H2O ![]() H++Cl-+HClO向正反应方向移动,故HClO浓度增大。
H++Cl-+HClO向正反应方向移动,故HClO浓度增大。
所以答案是:C
【考点精析】根据题目的已知条件,利用化学平衡状态本质及特征的相关知识可以得到问题的答案,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符合的是
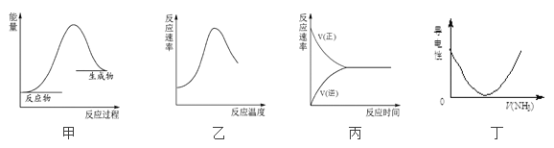
A. 图甲表示燃料燃烧反应的能量变化
B. 图乙表示酶催化反应的反应速率随反应温度的变化
C. 图丙表示可逆反应从加入反应物开始建立化学平衡的过程
D. 图丁表示将NH3通入醋酸溶液的过程中,溶液导电性的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时有关弱酸的电离平衡常数如下表:
弱酸的化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
则下列有关说法正确的是( )
A. 各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
B. a mol·L-1HCN溶液与b mol·L-1NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b
C. 冰醋酸中逐滴加水,则溶液的导电性和pH均先增大后减小
D. NaHCO3和Na2CO3混合溶液中,一定有2c(Na+)=3〔c(H2CO3)+c(HCO![]() )+c(CO
)+c(CO![]() )〕
)〕
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知空气—锌电池的电极反应为锌片:Zn+2OH--2e-=ZnO+H2O;碳棒:O2+2H2O+4e-=4OH-,据此判断,锌片是( )
A.正极,被还原B.正极,被氧化
C.负极,被还原D.负极,被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】刚刚从农业学院毕业的小刘,准备利用所学的知识在农村搞无土栽培。他配制的培养液中含有Mg2+、K+、Ca2+、Zn2+,其浓度都是0.1molL﹣1,培养一段时间后,培养液中剩余最多的是 ( )
A.Ca2+ B.Mg2+ C.Cu2+ D.K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下图所示实验装置的K闭合,下列判断正确的是

A. Zn电极上发生还原反应
B. 片刻后盐桥中的Cl-向乙装置中移动
C. 当电路中有0.2mol电子转移时,甲池增重质量为6.5克
D. 电子的流动方向从Zn→a ; b→Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对已达到化学平衡的下列反应2X(g)+Y(g) ![]() 2Z(g)减小压强时,对反应产生的影响是( )
2Z(g)减小压强时,对反应产生的影响是( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是几种常见的化学电源示意图,有关说法不正确的是( )
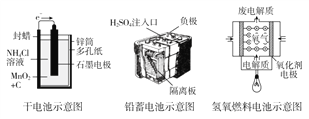
A. 上述电池分别属于一次电池、二次电池和燃料电池
B. 锌锰干电池在长时间使用后,锌筒变薄
C. 氢氧燃料电池是将化学能转化为热能,一种具有应用前景的绿色电源
D. 手机上使用的锂离子电池属于二次电池,是新一代可充电的绿色电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关生物体细胞组成元素的叙述中,错误的是( )
A. 在不同生物的体细胞内,组成它们的化学元素种类大体相同
B. 组成细胞的最基本元素是碳
C. 在同一生物的不同体细胞内,各种化学元素的含量相同
D. 组成生物体细胞的化学元素,在无机自然界中都能找到
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com