
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) ![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A.550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
【答案】B
【解析】
试题分析:A、由于反应在体积可变的恒压密闭容器中进行,当550℃时,若充入惰性气体,容器的容积扩大,使反应混合物的浓度减小,因此正,逆 均减小,由于该反应是气体体积增大的反应,减小压强,化学平衡向气体体积最大的正反应方向移动,A错误;B.根据图像可知在650℃时,反应达平衡后CO的体积分数是40%,则CO2的体积分数是60%,假设平衡时总物质的量是1mol,则反应产生CO 0.4mol,其中含有CO2 0.6mo,反应产生0.4molCO消耗CO2的物质的量是0.2mol,因此CO2转化率为0.2mol÷(0.6mol+0.2mol)×100%=25.0%,B正确;C.T℃时,平衡时CO2和CO的体积分数都是50%,若充入等体积的CO2和CO,根据反应方程式中的物质之间反应转化关系可知,相当于CO2增大的多,因此化学平衡向正反应方向移动,C错误;D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=![]() ,D错误。答案选B
,D错误。答案选B


科目:高中化学 来源: 题型:
【题目】不能说明氧的非金属性比硫强的事实是( )
A. H2O的热稳定性强于H2S
B. 硫化氢水溶液露置于空气中变浑浊
C. H2O是液体,H2S常温下是气体
D. 氧气和氢气化合比硫和氢气化合容易
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的5倍,G的3d轨道有3个未成对电子,请回答下列问题:
(1)F的基态原子电子排布式为 ,G在周期表的位置 。
(2)B、C、D的原子的第一电离能由小到大的顺序为 (用元素符号回答),A、C、D形成的离子化合物中的化学键类型 。
(3)下列关于B2A2(B原子最外层满足8电子稳定结构)分子和A2D2分子的说法正确的是 。
a.分子中都含有σ键和π键 b.B2A2分子的沸点明显低于A2D2分子
c.都是含极性键和非极性键的非极性分子 d.互为等电子体,分子的空间构型都为直线形
e.中心原子都是sp杂化
(4)用电子式表示E的氯化物的形成过程 。
(5)F的最高正价为+6价,而氧原子最多只能形成2个共价键,试推测CrO5的结构式________。
(6)C的最低价的氢化物为CH3,通常情况下,G2+的溶液很稳定,它与CH3形成的配位数为6的配离子却不稳定,在空气中易被氧化为[G(CH3)6]3+,该反应的离子方程式是 ,1 mol [G(CH3)6]3+配离子含有σ键数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
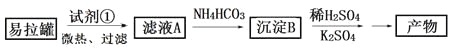
(1)为尽量少引入杂质,试剂①应选用___(填标号)。
a.HCl溶液 b.H2SO4溶液 c.氨水 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为________。
(3)沉淀B的化学式为________;将少量明矾溶于水,溶液呈弱酸性,其原因是__________。
(4)已知:Kw=1.0×10-14,Al(OH)3![]() AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体,回答下列问题:
(1)M元素位于周期表中的第______周期、_______族。
(2)Z元素是____,其在自然界中常见的二元化合物是____。
(3)X与M的单质在高温下反应的化学方程式为______,产物分子为直线形,其化学键属__________共价键(填“极性”或“非极性”)。
(4)四种元素中的____可用于航空航天合金材料的制备,其单质与稀盐酸反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. CS2分子的立体构型为V形
B. ClO3—的空间构型为平面三角形
C. SF6中有每个原子均满足最外层8电子稳定结构
D. SiF4和SO32—的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:
氧化性:IO3->Fe3+>I2;还原性:S2O32->I-
3I2+6OH-===5I-+IO3-+3H2O
KI+I2![]() KI3
KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份。第一份试液中滴加KSCN溶液后显血红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显血红色,该红色物质是______(用化学式表示);CCl4中显紫红色的物质是______(用电子式表示)。
②第二份试剂中加入足量KI固体后,反应的离子方程式为__________________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境中KI与氧气反应的化学方程式:__________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?____(填“是”或“否”),并说明理由:_________________________。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是

________。
A.Na2S2O3 B.AlCl3C.Na2CO3D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com