
| A. | 19种 | B. | 10种 | C. | 16种 | D. | 12种 |
分析 有机物Q的分子式为C10H12O3,不饱和度Ω=$\frac{10×2+2-12}{2}$=5,属于芳香族化合物,一定条件下Q遇足量NaHCO3、Na均能产生气体,且生成气体体积比(同温同压)为1:1,说明分子中含有1个羟基、1个羧基,分子结构中环上的一氯代物只有两种,则苯环上有2个取代基,且为对位位置,以此解答该题.
解答 解:有机物Q的分子式为C10H12O3,不饱和度Ω=$\frac{10×2+2-12}{2}$=5,属于芳香族化合物,一定条件下Q遇足量NaHCO3、Na均能产生气体,且生成气体体积比(同温同压)为1:1,说明分子中含有1个羟基、1个羧基,分子结构中环上的一氯代物只有两种,则苯环上有2个取代基,且为对位位置,
可能的结构有:如取代基为-OH和-C3H6COOH,则-COOH可取代-C3H7的H,有5种;
如取代基为HOCH2-和-C2H4COOH,则-COOH可取代-C2H5的H,有2种;
如取代基为HOCH2CH2-和-CH2COOH,则-OH可取代-C2H5的H,有2种;
如取代基为H-CH2CH2CH2OH和-COOH,则-OH可取代-C3H7的H,有5种;
如取代基为-CH3和-CH2CH2COOH,则-OH、-COOH可取代-CH3、-C2H5的H,有6种;
如取代基为-CH2CH3和-CH2COOH,则-OH可取代-CH3、-C2H5的H,有3种且存在对位,共19种.
故选A.
点评 本题考查有机物同分异构体的判断,为高频考点,侧重于学生的分析能力的考查,题目侧重于位置异构的考查,难度中等,答题时注意理清思路.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2O的质量为18 | |
| B. | CH4的摩尔质量为16g | |
| C. | 3.01×1023个SO2分子的质量为32g | |
| D. | 标准状况下,1 mol任何物质体积均为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:9 | B. | 1:36 | C. | 1:8 | D. | 8:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
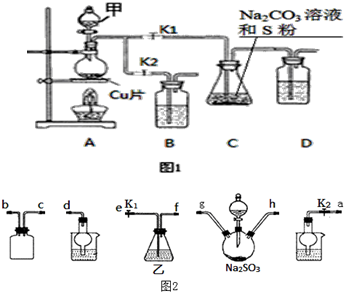
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
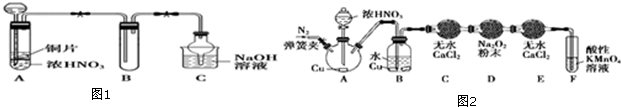
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③②④ | B. | ④①②③ | C. | ④①③② | D. | ①④③② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 周期表中同周期元素从左到右,元素的电负性逐渐增大 | |
| B. | 周期表中同主族元素从上到下,元素的电负性逐渐增大 | |
| C. | 电负性越大,金属性越强 | |
| D. | 电负性越小,非金属性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
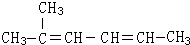 2-甲基-2,4-己二烯.
2-甲基-2,4-己二烯.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com