
【题目】在2A+B![]() 3C+4D中,表示该反应速率最快的是( )
3C+4D中,表示该反应速率最快的是( )
A.v(A) = 0.7mol·L-1·S-1 B.v(B) = 0.3 mol·L-1·S-1
C.v(C) = 0.8mol·L-1·S-1 D.v(D) = 1 mol·L-1·S-1
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】甲、乙两元素原子的L层电子数都是其他层电子总数的2倍,甲的原子半径大于乙的原子半径,下列说法正确是( )
A. 甲、乙处于同一周期 B. 它们中有一种元素位于第ⅥA族
C. 乙的最高价氧化物与甲的单质不反应 D. 简单甲离子的电子式为:Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.10 mol L-1的氨水滴定10.00 mL a mol L-1的盐酸,溶液的pH与氨水的体积(V)的关系如图所示。已知:N点溶液中存在:c(H+)=c(OH-)+c(NH3·H2O),下列说法正确的是
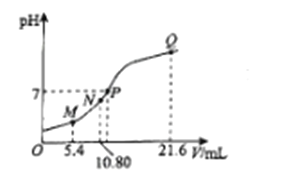
A. M点溶液中存在:c(H+)=c(OH-)+2c(NH3·H2O)+ c(NH4+)
B. N、Q两点溶液中NH3 H2O的电离常数:N<Q
C. P 点氨水过量,c(NH4+)> c(Cl-)
D. a=0.054
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向饱和澄清石灰水中加入一定量的生石灰,充分反应后恢复到原温度,下列有关说法中,正确的是
A. 溶液中Ca2+数目增加 B. 溶液中Ca2+数目减少
C. 溶液中OH-浓度减少 D. 溶液中OH-浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法不正确的是( )
A. 所有糖类、油脂、蛋白质在一定条件下都能发生水解
B. 羊毛和棉线可用燃烧法鉴别
C. 有机化合物中每个碳原子最多形成4个共价键
D. 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫元素有多种化合价,可形成多种化合物。 H2S和SO2在工农业生产中具有重要应用。
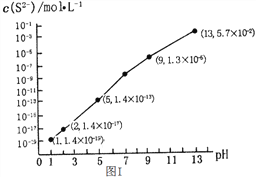
(1)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10 mol/L H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图I所示(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的c(H2S)+c(HS-)=____________mol/L;
②某溶液含0.01 mol/LFe2+、未知浓度的Mn2+和0.10 mol/L H2S,当溶液pH=________时,Fe2+开始沉淀;当Mn2+开始沉淀时,溶液中![]() =____________。
=____________。
【已知:KSP(FeS)=1.4×10-19,KSP(MnS)=2.8×10-13】
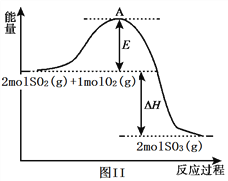
(2) 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:SO2(g)+1/2O2(g)![]() SO3(g) △H=-99kJ/mol。某温度下该反应的平衡常数K=3.33。反应过程的能量变化如图II所示。
SO3(g) △H=-99kJ/mol。某温度下该反应的平衡常数K=3.33。反应过程的能量变化如图II所示。
①图II中ΔH=____________ kJ/mol;该反应通常用V2O5作催化剂,加V2O5会使图中A点降低,原因是_____________________________________________________ 。
②该温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正)______ v(逆)(填“<”、“>”或“=”)。
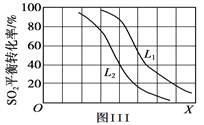
③L(L1、L2)、X可分别代表压强或温度。图III表示L一定时,SO2(g)的平衡转化率随X的变化关系。则X代表的物理量是____________;L1、L2的大小关系为L1_________L2(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物的鉴别方法(必要时可以加热),不能达到目的的是( )
A. 用银氨溶液鉴别葡萄糖、甲酸、乙酸和乙醇溶液
B. 用碘水鉴别淀粉和纤维素
C. 用浓硝酸鉴别蚕丝和人造丝
D. 用氢氧化钠溶液鉴别植物油、汽油和甘油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴(Co)、镍(Ni)是同族元素,它们的化合物在工业上有重要的应用。
(1)现将含0.5mol FeCl3的溶液和含0.5mol KSCN的溶液混合,混合后溶液体积为1L,已知溶液存在平衡:Fe3+(aq)+SCN-(aq) ![]() Fe(SCN)2+(aq)(忽略其它过程)。
Fe(SCN)2+(aq)(忽略其它过程)。
平衡浓度c[Fe(SCN)2+]与温度T的关系如图所示:
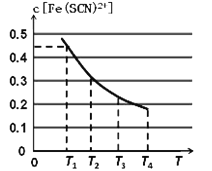
则该反应△H____0(填“>”或“<”),温度为T1时,反应在5秒钟时达到平衡,平c[Fe(SCN)2+]=0.45 mol/L,求达到平衡时的平均反应速率v(SCN-)=____mol·L-1·S-1,该温度下的Fe3+的平衡转化率为_____,该温度下反应的平衡常数为__________。
(2)草酸钴(CoC2O4)是一种难溶于水的浅粉红色粉末,通常用硫酸钴溶液和草酸铵溶液反应制得,写出该反应的离子方程式:______________________。
(3)已知某溶液中,Co2+、Ni2+的浓度分别为0.60mol/L和1.2mol/L,取一定量的该溶液,向其中滴加NaOH溶液,已知Ksp[Co(OH)2]=6.0×10﹣15,Ksp[Ni(OH)2]=2.0×10﹣15,当Co(OH)2开始沉淀时,溶液中![]() 的值等于______。(取两位有效数字)
的值等于______。(取两位有效数字)
(4)CoxNi(1-x)Fe2O4 (其中Co、Ni均为+2价)可用作H2O2分解的催化剂,具有较高的活性。两种不同方法制得的催化剂在10℃时催化、分解6%的H2O2溶液的相对初始速率随x变化的曲线如图所示。
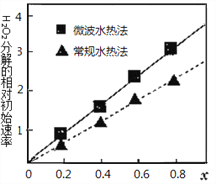
由图中信息可知:__________法制取得到的催化剂活性更高;Co2+、Ni2+ 两种离子中催化效果较好的是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com