
南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为28(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
(1)该泉水属于_________硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂添加时先加________ 后加________,原因是_____________________________________________________________。
(3)目前常用阳离子交换树脂如NaR、HR来进行水的软化,若使用HR作为阳离子交换树脂, 则水中的Ca2+、Mg2+与交换树脂的________起离子交换作用。若使用NaR作为阳离子交换树脂,失效后可放入5%~8%_____________溶液中再生。
(4)岛上还可以用海水淡化来获得淡水。下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:
①阳离子交换膜是指______________(填A或B)。
②写出通电后阳极区的电极反应式:_____________________________.
阴极区的现象是:_______________________________________________.
(1)永久(2分)
(2)石灰 纯碱 过量的钙离子可用纯碱沉淀下来(每空2分)
(3)H+ NaCl (每空1分)
(4)①B (1分) ②2Cl--2e-= Cl2↑ 有气体放出,
解析试题分析:(1)永久性硬水是指硫酸镁、硫酸钙等盐类加热煮沸后不能不能除去的硬度,而含碳酸氢镁、碳酸氢钙的硬水可通过加热煮沸后沉淀除去,称为暂时性硬水,本题中的硬水中含硫酸根离子和氯离子,不含碳酸氢根离子,所以是永久性硬水
(2)石灰只与镁离子反应不和钙离子反应,而纯碱和二者都反应,所以先加石灰,后加纯碱,原因是过量的钙离子可用纯碱沉淀下来
(3)阳离子交换树脂与其同号离子进行交换,所以Ca2+、Mg2+与交换树脂的H+交换, 若使用NaR作为阳离子交换树脂,则Ca2+、Mg2+与交换树脂的Na+交换,失效后,放在氯化钠的溶液里即可
(4)①通电后钙镁离子应移向电源负极,所以B为阳离子交换膜
②阳极区是阴离子放电,按照离子的放电顺序是氯离子放电,电极反应方程式为:2Cl--2e-= Cl2↑;阴极区是氢离子放电,所以阴极区有气体放出,同时由于氢离子放电导致阴极区氢氧根离子浓度增大,定向移动来的钙镁离子与氢氧根离子结合形成沉淀
考点:考查硬水中钙镁离子的除去方法,电解中离子放电顺序、离子的定向移动


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
某化学小组用下图装置电解CuCl2溶液制少量漂白液: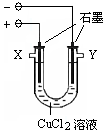

(1)其阳极的反应式是: ;导气管W端应与出气口 连接。
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质。
查阅资料显示:
| 物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2( OH)3Cl |
| 性质 | 白色固体、不溶水 | 绿色固体、不溶水 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。
回答下列问题:
(1)此原电池的正极是石墨 (填“a”或“b”),发生 反应。
(2)电池工作时,盐桥中的SO42-移向 (填“甲”或“乙”)烧杯。
(3)两烧杯中的电极反应式分别为:甲 ,乙 。
(4)若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
银器皿日久表面变黑,这是由于生成硫化银,有人设计用原电池原理加以除去,其方法是:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中,放置一段时间,黑色会褪去而银不会损失。试回答:在原电池反应中,负极发生的反应为 ;正极发生的反应为 ;反应过程中有臭鸡蛋气味气体产生,则原电池的总反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
根据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示,其中盐桥为琼胶饱和KNO3盐桥。请回答下列问题。 ( )
(1)电极X的材料是________,电解质溶液Y是________。
(2)银电极为电池的________极,写出两电极的电极反应式:
银电极:_________________________________________________;
X电极:___________________________________________________。
(3)外电路中,电子是从________电极流向________电极。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
太阳能电池可用做电解的电源(如图)。
(1)若c、d均为惰性电极,电解质溶液为硫酸铜溶液,电解过程中,c极先无气体产生,后又生成气体,则c极为________极,在电解过程中,溶液的pH________(填“增大”、“减小”或“不变”),停止电解后,为使溶液恢复至原溶液应加入适量的________。
(2)若c、d均为铜电极,电解质溶液为氯化钠溶液,则电解时,溶液中氯离子的物质的量将________(填“增大”、“减小”或“不变”)。
(3)若用石墨、铁作电极材料,可组装成一个简易污水处理装置。其原理是:加入试剂调节污水的pH在5.0~6.0之间。接通电源后,阴极产生的气体将污物带到水面形成浮渣而刮去,起到浮选净化作用;阳极产生的有色沉淀具有吸附性,吸附污物而沉积,起到凝聚净化作用。该装置中,阴极的电极反应式为__________________________;阳极区生成的有色沉淀是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应______________________________________
银片上发生的电极反应______________________________________
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:
①产生氢气的体积(标准状况);②通过导线的电量。(已知NA=6.02×1023 mol-1,电子电荷为1.60×10-19 C)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg·L-1 | 9 360 | 83 | 200 | 1 100 | 16 000 | 1 200 | 118 |


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
①碱洗的目的是洗去铝材表面的自然氧化膜,碱洗时候常有气泡冒出,原因是 (用离子方程式表示)。
为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的 。
a.NH3 b.CO2 c. NaOH d.HNO3
②以铝材为阳极,在过量的H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为 。取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,原因是 ; (用离子方程式表示)。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是
(3)利用下面的装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应该置于 处。
若X为锌,开光K置于M处,该电化学防护法称为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com