
 “绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图所示装置与操作以替代相关的课本实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )
“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图所示装置与操作以替代相关的课本实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )| A. | 钠着火燃烧产生苍白色火焰 | |
| B. | 反应生成的大量白烟是氯化钠晶体 | |
| C. | 管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 | |
| D. | 管右端浸有淀粉KI溶液的棉球颜色变化可判断氯气是否被碱液完全吸收 |
分析 氯气性质活泼,易与活泼金属钠发生化合反应生成NaCl,火焰呈黄色,氯气易与NaOH溶液反应而被吸收,氯气具有强氧化性,与碘化钾发生置换反应.
解答 解:A.钠着火燃烧产生黄色火焰,故A错误;
B.氯气性质活泼,易与活泼金属钠发生化合反应生成NaCl,反应时有大量白烟,白烟是氯化钠晶体,故B正确;
C.NaOH与氯气反应,可吸收过量的氯气,以免其污染空气,故C正确;
D.氯气有强氧化性,能与KI发生置换反应生成碘,当浸有淀粉KI溶液的棉球未变色,表明氯气已被碱液完全吸收,故D正确;
故选A.
点评 本题考查钠和氯气的性质,侧重考查元素化合物知识,会根据实验现象分析实验原理,注意钠的焰色反应呈黄色,易错选项是A.


科目:高中化学 来源: 题型:选择题
| A. | 电解稀硫酸溶液,实质上是电解水,故溶液的pH不变 | |
| B. | 电解稀氢氧化钠溶液,要消耗OH-,故溶液的pH减小 | |
| C. | 电解氯化钾溶液,在阴极上和阳极上析出的产物的物质的量之比为1:1 | |
| D. | 电解硫酸钠溶液,在阴极上和阳极上析出的产物的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯水的pH随着温度的升高而降低 | B. | 在35℃时,[H+]>[OH-] | ||
| C. | 在25℃和35℃时,[H+]=[OH-] | D. | 水的电离是吸热的 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-+CO32-+2H+→HCO3-+H2O | B. | 2OH-+CO32-+3H+→HCO3-+2H2O | ||
| C. | 2OH-+CO32-+4H+→CO2↑+2H2O | D. | OH-+CO32-+3H+→CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
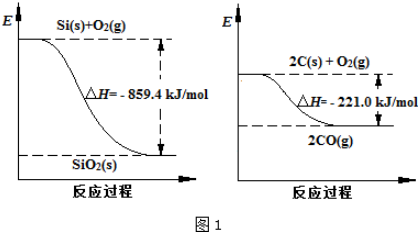
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
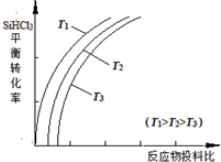
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,元素g的简单离子的结构示意图为
,元素g的简单离子的结构示意图为 ,二者的离子半径大小顺序为F->Al3+.
,二者的离子半径大小顺序为F->Al3+. ,该化合物中所含的化学键类型为离子键、共价键.
,该化合物中所含的化学键类型为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去苯中混有的少量苯酚:加入适量浓溴水,振荡、静置后过滤 | |
| B. | 0.5 mol NH4HSO4晶体中,含有H+数目约为0.5 NA | |
| C. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+) | |
| D. | 检验卤代烃中的卤原子:取足量液体与NaOH溶液共热后,再滴加AgNO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com