
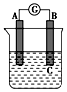
 如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )| A. | A是Zn,B是Cu,C为稀硫酸 | B. | A是Cu,B是Zn,C为稀硫酸 | ||
| C. | A是Cu,B是Fe,C为稀Cu(NO3)2溶液 | D. | A是Fe,B是Ag,C为稀AgNO3溶液 |
分析 原电池中负极的活泼性大于正极的活泼性,负极上金属失电子变成离子进入溶液,质量减少,正极上得电子发生还原反应,正极上析出物质,若析出的物质是金属,则正极质量增加变粗,据此解答.
解答 解:该原电池中,A极逐渐变粗,说明A上发生还原反应,A作正极;B极逐渐变细,说明B失电子发生氧化反应,B作负极,则B的活泼性大于A的活泼性,所以排除AD选项;
A极逐渐变粗,说明有金属析出,B选项析出氢气不是金属,C选项析出金属银,所以C符合题意,
故选C.
点评 本题考查了原电池原理,难度不大,明确正负极的判断方法,一般是根据金属的活泼性判断正负极,但如:Mg、Al、NaOH溶液构成的原电池,铝作负极,镁作正极,根据电解质溶液参与的化学反应来判断正负极是易错点.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
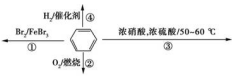
| A. | 反应①、③均为取代反应 | |
| B. | 反应②的现象是火焰明亮并带有浓烟 | |
| C. | 反应④的产物中所有原子在同一平面上 | |
| D. | 甲苯(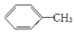 )与苯互为同系物 )与苯互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子式为C11H18O2 | |
| B. | 该化合物含有两种官能团 | |
| C. | 该化合物能在碱性溶液中发生取代反应 | |
| D. | 该化合物能使酸性KMnO4溶液褪色,发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | K+、NH4+、Fe2+、Mg2+、Cu2+ |
| 阴离子 | OH-、Cl-、CO32-、SO42- |

| A. | 滤液A中可能含有K+ | |
| B. | 沉淀B中一定含有Mg(OH)2 | |
| C. | 由沉淀A推断原溶液中一定含有SO42- | |
| D. | 原溶液中只含有NH4+、Fe2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化镁 | B. | 氧化铁 | C. | 二氧化锰 | D. | 氧化镍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol羟基中所含电子数为5NA | |
| B. | 1mol苯乙烯( )分子中含有碳碳双键的个数为4NA )分子中含有碳碳双键的个数为4NA | |
| C. | 标准状况下,11.2L的二氯甲烷所含的分子数为0.5NA | |
| D. | 常温下,7.8 gNa2O2中含有的离子总数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,6.0g NO和2.24L O2混合,所得气体的分子数目为0.2NA | |
| B. | 常温常压下,0.1mol Na2O和Na2O2组成的混合物中,阴离子的数目为0.1NA | |
| C. | C2H4和C3H6的混合物的质量为mg,所含碳氢键的数目为$\frac{3m}{14}$NA | |
| D. | 1mol甲基( )所含的电子数为7NA )所含的电子数为7NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com