
分析 (1)根据密度之比等于相对分子质量之比计算A的相对分子质量,结合烷烃的组成通式确定分子式,书写可能的结构简式;
(2)根据烷烃的组成通式CnH2n+2确定分子式;
(3)根据烷烃的组成通式CnH2n+2确定分子式;
(4)烷烃CnH2n+2中含有(n-1)个碳碳单键、(2n+2)个C-H单键.
解答 解:(1)根密度之比等于相对分子质量之比,A的相对分子质量为15×2=30,烷烃的组成通式CnH2n+2,则14n+2=30,解得n=2,故该烷烃的分子式为C2H6,结构简式为:CH3CH3,
故答案为:C2H6;CH3CH3;
(2)烷烃的组成通式CnH2n+2,故2n+2=200,解得n=99,故该烷烃的分子式为:C99H200,
故答案为:C99H200;
(3)烷烃D含有5个碳原子,则H原子数目为5×2+2=12,故D的分子式为:C5H12,
故答案为:C5H12;
(4)烷烃CnH2n+2中含有(n-1)个碳碳单键、(2n+2)个C-H单键,则(n-1)+(2n+2)=22,解得n=7,故该烷烃的分子式为:C7H16,
故答案为:C7H16.
点评 本题考查烷烃分子式确定,题目贴近基础,比较基础,注意利用烷烃的组成通式进行解答,理解烷烃的结构特点.


科目:高中化学 来源: 题型:选择题
| A. | 硅(半导体材料) | B. | 二氧化硅(制光导纤维) | ||
| C. | Na2Si03 (用作粘合剂,俗称水玻璃) | D. | Al(OH)3(用作胃药,俗称人造刚玉) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | Mg、Al与同浓度盐酸反应,Mg更剧烈 | ||
| C. | 稳定性:HBr>HI | D. | 酸性:H3PO4>HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗铜精炼时,与电源正极相连的是纯铜,阳极反应式为Cu-2e-═Cu2+ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl--2e-═Cl2↑ | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A是非电解质 | B. | A是强电解质 | C. | A是共价化合物 | D. | A是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
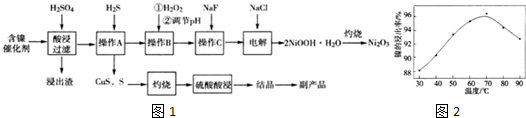
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH02 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它是由σ键形成的(根据原子轨道的重叠程度填写).
,它是由σ键形成的(根据原子轨道的重叠程度填写).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应达到平衡状态后,各物质浓度不变,反应停止 | |
| B. | 反应达到平衡状态后,单位时间内生成1molN2的同时消耗3molH2 | |
| C. | 在上述条件下,N2不可能100%转化为NH3 | |
| D. | 使用催化剂是为了加快反应速率,提高生产效率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com