

分析 海水结晶得到粗盐和母液,母液加入石灰乳沉镁离子生成氢氧化镁沉淀,过滤后的沉淀中加入盐酸生成氯化镁溶液,浓缩结晶得到氯化镁晶体,氯化氢气流中失水得到氯化镁,电解熔融氯化镁得到镁和氯气,所以固体A为镁,气体B为氯气,据此答题,
(1)固体和液体分离用过滤;
(2)分析可知,氯化镁固体电解生成固体A为镁,气体B为氯气;
(3)海水中镁元素是化合态;
(4)Mg(OH)2与盐酸反应生成氯化镁和水;
(5)镁在二氧化碳中燃烧生成氧化镁和碳;
解答 解:海水结晶得到粗盐和母液,母液加入石灰乳沉镁离子生成氢氧化镁沉淀,过滤后的沉淀中加入盐酸生成氯化镁溶液,浓缩结晶得到氯化镁晶体,氯化氢气流中失水得到氯化镁,电解熔融氯化镁得到镁和氯气,所以固体A为镁,气体B为氯气,
(1)根据上面的分析可知,操作a的名称是过滤,
故答案为:过滤;
(2)根据上面的分析可知,固体A为镁,气体B为氯气,
故答案为:Mg,Cl2;
(3)海水中的镁元素主要以氯化镁形式存在,所以是化合态的形式存在,
故答案为:化合态;
(4)Mg(OH)2与盐酸反应生成氯化镁和水,反应的离子方程式为Mg(OH)2+2H+=Mg2++2H2O,
故答案为:Mg(OH)2+2H+=Mg2++2H2O;
(5)镁在二氧化碳中燃烧生成氧化镁和碳,反应的化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
点评 本题考查较综合,涉及粗盐提纯、氧化还原反应判断,离子方程式书写等,为高考常见题型,利用所学知识结合流程图信息是解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
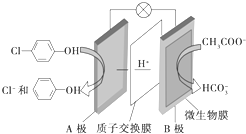 含乙酸钠和对氯酚
含乙酸钠和对氯酚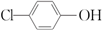 的废水可以利用微生物电池处理,其原理如图所示.下列说法中正确的是( )
的废水可以利用微生物电池处理,其原理如图所示.下列说法中正确的是( )| A. | B极是电池的正极 | |
| B. | H+向A极移动 | |
| C. | B极的电极反应式为CH3COO-+8e-+4H2O═2HCO3-+9H+ | |
| D. | 此电池可以在高温下使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 屠呦呦女士用乙醚从黄花蒿中提取出青蒿素,该技术应用了萃取原理 | |
| B. | 解释化学反应速率理论有碰撞理论和过渡态理论,其中过渡态理论可解释温度、催化剂等因素对化学反应速率的影响 | |
| C. | 离子交换膜在工业上应用广泛,如氯碱工业使用阳离子交换膜 | |
| D. | 用氨水法处理燃煤烟气中的二氧化硫,既可消除其污染,又可得到副产品硫酸铵 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁跟稀硫酸反应:2Fe+6H+→2Fe3++3H2↑ | |
| B. | 向氯化亚铁溶液中通入氯气:Fe2++Cl2→Fe3++2Cl- | |
| C. | 盐酸滴入氢氧化钡溶液中:H++OH-=H2O | |
| D. | 氯气通入NaOH溶液中:Cl2+2OH-=Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅的导电性介于金属和绝缘体之间,是良好的半导体 | |
| B. | 加热到一定温度时,硅能与氯气、氧气等非金属反应 | |
| C. | 利用二氧化硅与C反应能制得粗硅 | |
| D. | 二氧化硅性质较稳定,常温下不与任何物质反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | 2F2+2H2O═4HF+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 天津8.12爆炸事件中,港口保存有NaCN等剧毒物品.
天津8.12爆炸事件中,港口保存有NaCN等剧毒物品.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
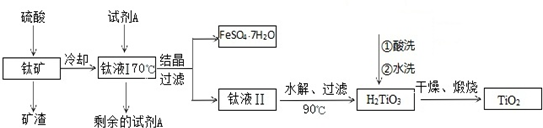
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com