
【题目】1797年法国化学家沃克兰从当时称为红色西伯利亚矿石中发现了铬,后期人类发现铬元素在其他方面有重要用途。
(1)Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为K____Cr (填“>”或“<”)。
(2)氮化铬(CrN)具有极高的硬度和力学强度、优异的抗腐蚀性能,请写出Cr3+基态核外电子排布式为____;CrN 晶体类型与 NaCl 晶体相同,但前者熔点(1282℃)比后者(801℃)的高,主要原因是____。
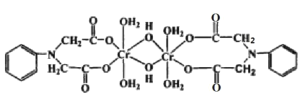
(3)Cr3+可与很多分子或离子形成配合物, 如图配合物中 Cr3+的配位数为_________,配体中采取sp3杂化的元素是__________。
(4)铬的一种氧化物的晶胞结构如图所示,其中氧离子与晶体镁堆积方式一致,铬离子在其八面体空隙中(如:CrA在O1、O2、O3、O4、O5、O6 构成的八面体空隙中)。
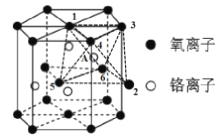
①该氧化物的化学式为 ______。
②该晶胞有 _____%八面体空隙未填充阳离子。
③已知氧离子半径a cm,晶胞的高为bcm,NA代表阿伏加德罗常数的值,该晶体的密度为____g·cm-3(用含a、b和NA的代数式表示)。
【答案】< [Ar]3d3 氮化铬中的离子所带电荷数多,晶格能较大 6 C、N、O Cr2O3 33.3 
【解析】
根据离子半径和核外电子排布比较电离能大小,结合核外电子排布规律书写核外电子排布式,根据配合物理论判断离子配位数,结合杂化轨道互斥理论判断杂化方式,利用均摊法得出物质的化学式,结合立体几何知识根据公式![]() 进行晶胞的计算。
进行晶胞的计算。
(1)Cr原子的原子半径小、核电数更大,对核外电子的吸引更大,故第一电离能K<Cr;
(2)Cr为24号元素,其原子核外共有24个电子,Cr失去3个电子得到Cr3+,则Cr3+的核外电子排布式为1s22s22p63s23p63d3或[Ar]3d3,氮化铬(CrN)和NaCl均为离子晶体,氮化铬中的离子所带电荷数多,晶格能较大,所以熔点:CrN>NaCl;
(3)根据图示配合物的结构分析可知,Cr3+的配位数为6,配体中C、N、O采取sp3杂化;
(4)①有晶胞示意图可知,该晶胞中氧离子位于晶胞的顶点、面心和体内,则1个晶胞中氧离子的个数为![]() ,铬离子位于晶胞的体内,则1个晶胞中铬离子的个数为4,氧离子和铬离子的个数比为6:4=3:2,则该氧化的化学式为Cr2O3;
,铬离子位于晶胞的体内,则1个晶胞中铬离子的个数为4,氧离子和铬离子的个数比为6:4=3:2,则该氧化的化学式为Cr2O3;
②该晶胞中共有12个正八面体空隙,其中8个正八面体空隙中填充了Cr3+,则该晶胞中有4个未填充阳离子的八面体空隙,所占比例为![]() ;
;
③已知氧离子的半径为a cm,则底面边长为2a cm,又晶胞的高度为b cm,所以晶胞的体积![]() ,一个晶胞中含有2个Cr2O3,其质量
,一个晶胞中含有2个Cr2O3,其质量![]() ,所以该晶体的密度
,所以该晶体的密度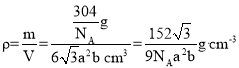 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作不能达到相应实验目的的是( )
选项 | 实验目的 | 实验操作 |
A | 配制 | 先将 |
B | 比较醋酸与碳酸酸性的强弱 | 将 |
C | 检验溶液中是否含有 | 取少量试剂于试管中,加入浓 |
D | 试清洗碘升华实验所用试管 | 先用酒精清洗,再用水冲洗 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2-最低浓度的对数值lg c(S2-)与lg c(M2+)关系如图所示。下列说法不正确的是

A.25℃时,Ksp(CuS)约为l×10-35
B.向Cu2+浓度为10-5mol/L废水中加入ZnS粉末,会有CuS沉淀析出
C.向l00mL浓度均为10-5mol/L Zn2+、Cu2+的混合溶液中逐滴加入10-4mol/L的Na2S溶液,Cu2+先沉淀
D.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制500 mL 0.2 mol/L的FeSO4溶液,实验操作步骤有:
①在天平上称出27.8 g绿矾,把它放在烧杯里,用适量的蒸馏水使它完全溶解
②把制得的溶液小心地注入500 mL容量瓶中
③继续向容量瓶中加蒸馏水至液面距刻度1~2 cm处。改用胶头滴管小心滴加蒸馏水至溶液
凹液面底部与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶并轻轻摇匀
⑤将容量瓶塞塞紧,充分摇匀
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)________________________。
(2)本实验用到的基本仪器有__________________________________________。
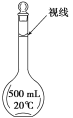
(3)某同学观察液面的情况如图所示,对所配溶液浓度有何影响?会________(填“偏高”、“偏低”或“无影响”)。
(4)若出现如下情况,所配溶液浓度将偏高还是偏低:
没有进行操作步骤④,会________; 加蒸馏水时不慎超过了刻度,会______。
(5)若实验过程中出现如下情况应如何处理?
加蒸馏水时不慎超过了刻度,应____________________________________;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面, 应________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向二元弱酸H2Y溶液中滴加 KOH 溶液,所得混合溶液的 pH 与 P[P=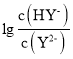 或
或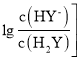 变化关系如图所示。下列说法正确的是
变化关系如图所示。下列说法正确的是
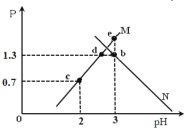
A.曲线 M 表示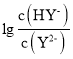 随 pH 的变化关系
随 pH 的变化关系
B.Ka2 的数值是10-6
C.e 点溶液中:2c(Y2-)+c(HY-)﹣c(K+)+c(OH-)=0.001mol·L-1
D.KHY 溶液中:c(K+)>c(HY﹣)>c(H+)>c(Y2-)>c(H2Y)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,将10mol CO和一定量的H2S混合加热并达到下列平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
A.CO、H2S的转化率之比为1∶1
B.达平衡后H2S的体积分数为4%
C.升高温度,COS浓度减小,表明该反应是吸热反应
D.恒温下向平衡体系中再加入CO、H2S、COS、H2各1mol,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量,实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为a g。
②装好实验装置。
③检查装置气密性。
④加热,开始反应,直到产生一定量的气体。
⑤停止加热(如图所示,导管出口高于液面)。
⑥测量收集到的气体的体积。
⑦准确称量试管和残留物的质量为b g。
⑧测量实验室的温度。
⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。
⑩处理实验数据,求出氧气的摩尔质量。

回答下列问题:
(1)如何检查装置的气密性 ____________________________________________。
(2)以下是测量收集到的气体体积必须包括的几个步骤:①调整量筒内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是__________(请填写步骤代号)。
(3)测量收集到的气体体积时,如何使量筒内外液面的高度相同?________________。
(4)如果实验中得到的氧气体积是c L(25 ℃、1.01×105 Pa),水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简)M(O2)=_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下将1 L纯净的CH4在空气中完全燃烧,生成CO2和液态水,放出39.75 kJ热量,则燃烧的热化学方程式为( )
A.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-39.75 kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=890.4 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.4 kJ/mol
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=39.75 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某太阳能电池的工作原理如图所示。下列说法正确的是
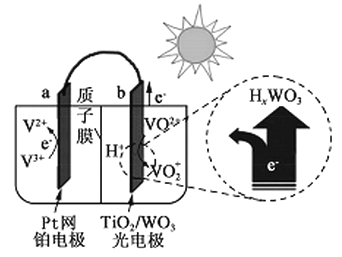
A. 光照时,b极的电极反应式为VO2+-e-+H2O=VO2++2H+
B. 光照时,毎转移2mol电子,有2mol H+由a极区经质子交换膜向b极区迁移
C. 夜间,a极的电极反应式为V3++e-=V2+
D. 硅太阳能电池供电原理与该电池相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com