
”¾ĢāÄæ”æ2001ÄźŹĒĪ°“óµÄ»Æѧ¼Ņ”¢1954ÄźÅµ±“¶ū»Æѧ½±µĆÖ÷”¢ÖųĆūµÄ»Æѧ½į¹¹“󏦔¢20ŹĄ¼ĶµÄæĘѧ¹Ö½Ü±«ĮÖ(L.Pauling)½ĢŹŚµÄµ®³½100ÖÜÄź”£1994ÄźÕāĪ»ĄĻČĖŠ»ŹĄŗó£¬ČĖĆĒ“ņæŖĖūµÄ°ģ¹«ŹŅ£¬·¢ĻÖĄļĆęÓŠŅ»æéŗŚ°å£¬»µĆĀśĀśµÄ£¬ĘäÖŠŅ»øö½į¹¹Ź½ČēĶ¼ĖłŹ¾”£ĄĻČĖĪŖŹ²Ć“»Õāøö½į¹¹Ź½£æĖüÄÜŗĻ³ÉĀš£æĖüÓŠŹ²Ć“ŠŌÖŹ£æ²»µĆ¶ųÖŖ”£ÕāŹĒ±«ĮÖĮōøųŹĄČĖµÄŅ»øöĆÕ£¬Ņ²ŠķÕāŹĒÓĄŌ¶ĪŽ·Ø½āæŖµÄĆÕ£¬Ņ²ŠķÓŠ³ÆŅ»ČÕÄć¾ĶÄܽāæŖĖü”£²»¹Ü½į¹ūČēŗĪ£¬ČĆĪŅĆĒĻȶŌÕāøö½į¹¹×÷Ņ»·¬ĮĖ½ā”£

(1)ĖüµÄ·Ö×ÓŹ½ŹĒ__________________________________________________________”£
(2)ĖüµÄĖłÓŠŌ×ÓŹĒ·ńæÉÄÜ“¦ÓŚĶ¬Ņ»øöĘ½ĆęÉĻ£æ________(Ģī”°æÉÄÜ”±»ņ”°²»æÉÄÜ”±)”£
(3)ĖüŹĒ·ń“ųÓŠµēŗÉ£æ________(Ģī”°ŹĒ”±»ņ”°·ń”±)”£
(4)øĆ·Ö×ÓÖŠspŌӻƵĵŖŌ×ÓÓŠ___øö£»sp2ŌӻƵĵŖŌ×ÓÓŠ___øö£»sp3ŌӻƵĵŖŌ×ÓÓŠ_____øö”£
(5)ĪŖŹ²Ć“ČĖĆĒĶĘ²āĖüŹĒÕØŅ©£æ______________________________________________”£
”¾“š°ø”æC6H2O2N10 æÉÄÜ ·ń 1 9 0 Ėü·Ö½āÄܲśÉś“óĮæŗÜĪČ¶ØµÄĘųĢåN2
”¾½āĪö”æ
£Ø1£©øł¾Ż½į¹¹¼ņŹ½ŹéŠ“·Ö×ÓŹ½£»
£Ø2£©øł¾Ż±½»·µÄ¹²Ćę½į¹¹ŗĶµŖŌ×ӵijɼüĢŲµćĄ“Č·¶ØøĆÓŠ»śĪļµÄ¹²ĆęĒéæö£»
£Ø3£©øł¾ŻŌ×ӵijɼüĒéæöĄ“Č·¶ØµēŠŌ£»
£Ø4£©spŌӻƵÄNŌ×Ó±ķĻÖĪŖĻߊĶ½į¹¹£¬sp2ŌÓ»ÆNŌ×Ó±ķĻÖĪŖČż½Ē׶½į¹¹£»sp3ŌӻƵÄNŌ×Ó±ķĻÖĪŖĖÄĆęĢå½į¹¹£»
£Ø5£©²śĪļÖŠÓŠ“óĮæµÄµŖĘų£¬¶ųÄÜĮæŌ½µĶŌ½ĪČ¶Ø£¬·Å³öµÄČČĮæŌ½¶ą”£
£Ø1£©øł¾Ż½į¹¹¼ņŹ½ŹéŠ“·Ö×ÓŹ½ĪŖ£ŗC6H2O2N10£¬¹Ź“š°øĪŖ£ŗC6H2O2N10£»
£Ø2£©Ģ¼Ō×ÓŗĶµŖŌ×Ó¾łĻąµ±ÓŚÓŠ3øö¼Ūµē×Ó¶Ō£¬øł¾Ż¼Ū²ćµē×Ó¶Ō»„³āĄķĀŪ£¬æÉÖŖĖüĆĒĪŖĘ½ĆęČż½ĒŠĶ½į¹¹£¬ÓÉ“ĖĶĘ³öĢ¼Ō×ÓŗĶµŖŌ×Ó¹¹³ÉµÄ»·ĪŖĘ½Ćę½į¹¹£¬ŃõŌ×ÓÓŠ4¶Ōµē×Ó¶Ō£¬ĖüĆĒÅÅĮŠ·½Ź½ĪŖĖÄĆęĢå½į¹¹£¬¹ŹÓėŃõŌ×ÓĮ¬½ÓµÄĒāŌ×ÓŅ²æÉÄÜŌŚøĆĘ½ĆęÄŚ£¬Óė»·²»Ö±½ÓĻąĮ¬µÄ2øöµŖŌ×ÓŅ²æÉÄÜŌŚ“ĖĘ½ĆęÄŚ£¬ĖłŅŌĖüµÄĖłÓŠŌ×ÓæÉÄÜ“¦ÓŚĶ¬Ņ»øöĘ½Ćę£¬¹Ź“š°øĪŖ£ŗæÉÄÜ£»
£Ø3£©ĖłÓŠµÄŌ×ӳɼü¶¼“ļµ½ĮĖ±„ŗĶ£¬ĖłŅŌ²»“ųµēŗÉ£¬¹Ź“š°øĪŖ£ŗ·ń£»
£Ø4£©øł¾ŻNŌ×ӵijɼüĢŲµćŗĶ½į¹¹£¬æÉÖŖøĆ·Ö×ÓÖŠspŌӻƵÄNŌ×ÓÖ»ÓŠ![]() ½į¹¹µÄÖŠ¼äµŖŌ×Ó£»ĘäÓąµÄµŖŌ×Ó¶¼ŹĒsp2Ōӻƣ»Ć»ÓŠsp3ŌӻƵģ¬¹Ź“š°øĪŖ£ŗ1£»9£»0”£
½į¹¹µÄÖŠ¼äµŖŌ×Ó£»ĘäÓąµÄµŖŌ×Ó¶¼ŹĒsp2Ōӻƣ»Ć»ÓŠsp3ŌӻƵģ¬¹Ź“š°øĪŖ£ŗ1£»9£»0”£
£Ø5£©øĆĪļÖŹ·Ö½ā»į²śÉś“óĮæŗÜĪČ¶ØµÄĘųĢåN2”£“ÓÄÜĮæ±ä»Æ½Ē¶ČĄ“æ“£¬Éś³ÉĪļµÄÄÜĮæŌ½µĶ£¬·“Ó¦·Å³öµÄÄÜĮæŌ½øߣ¬¹Ź“š°øĪŖ£ŗĖü·Ö½āÄܲśÉś“óĮæŗÜĪČ¶ØµÄĘųĢåN2”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æѤĄö¶ą²ŹµÄĪŽ»śŃÕĮĻµÄÓ¦ÓĆŌų““ŌģĮĖ¹Å“ś»ę»ŗĶ²ŹĢյĻŌ»Ķ”£Įņ»ÆļÓ(CdS)ŹĒŅ»ÖÖÄŃČÜÓŚĖ®µÄ»ĘÉ«ŃÕĮĻ£¬ĘäŌŚĖ®ÖŠµÄ³ĮµķČܽāĘ½ŗāĒśĻßČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
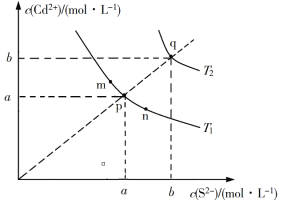
A. Ķ¼ÖŠaŗĶb·Ö±šĪŖT1”¢T2ĪĀ¶ČĻĀCdSŌŚĖ®ÖŠµÄČܽā¶Č
B. Ķ¼ÖŠø÷µć¶ŌÓ¦µÄKspµÄ¹ŲĻµĪŖ£ŗKsp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C. ĻņmµćµÄČÜŅŗÖŠ¼ÓČėÉŁĮæNa2S¹ĢĢ壬ČÜŅŗ×é³ÉÓÉmŃŲmpnĻßĻņp·½ĻņŅʶÆ
D. ĪĀ¶Č½µµĶŹ±£¬qµćµÄ±„ŗĶČÜŅŗµÄ×é³ÉÓÉqŃŲqpĻßĻņp·½ĻņŅʶÆ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»ÆѧŠ”×éÓĆČēĻĀ·½·Ø²ā¶Ø¾“¦ĄķŗóµÄ·ĻĖ®ÖŠ±½·ÓµÄŗ¬Įæ£Ø·ĻĖ®ÖŠ²»ŗ¬øÉČŲā¶ØµÄĪļÖŹ£©”£
¢ń£®ÓĆŅŃ×¼Č·³ĘĮæµÄKBrO3¹ĢĢåÅäÖĘŅ»¶ØĢå»żµÄa mol”¤L1 KBrO3±ź×¼ČÜŅŗ£»
¢ņ£®Č”v1 mLÉĻŹöČÜŅŗ£¬¼ÓČė¹żĮæKBr£¬¼ÓHSO4Ėį»Æ£¬ČÜŅŗŃÕÉ«³Ź×Ų»ĘÉ«£»
¢ó£®Ļņ¢ņĖłµĆČÜŅŗÖŠ¼ÓČėv2 mL·ĻĖ®£»
¢ō£®Ļņ¢óÖŠ¼ÓČė¹żĮæKI£»
¢õ£®ÓĆb mol”¤L1 Na2S2O3±ź×¼ČÜŅŗµĪ¶Ø¢ōÖŠČÜŅŗÖĮĒ³»ĘÉ«Ź±£¬µĪ¼Ó2µĪµķ·ŪČÜŅŗ£¬¼ĢŠųµĪ¶ØÖĮÖÕµć£¬¹²ĻūŗÄNa2S2O3ČÜŅŗv2 mL”£
ŅŃÖŖ£ŗI2+2Na2S2O3=2NaI+ Na2S4O6
Na2S2O3ŗĶNa2S4O6ČÜŅŗŃÕÉ«¾łĪŖĪŽÉ«
£Ø1£©¢ńÖŠÅäÖĘČÜŅŗÓƵ½µÄ²£Į§ŅĒĘ÷ÓŠÉÕ±”¢²£Į§°ō”¢½ŗĶ·µĪ¹ÜŗĶ____________”£
£Ø2£©¢ńÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ_______________________________”£
£Ø3£©¢óÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ_________________________________”£
£Ø4£©¢ōÖŠ¼ÓKIĒ°£¬ČÜŅŗŃÕÉ«ŠėĪŖ»ĘÉ«£¬ŌŅņŹĒ______________________________”£
£Ø5£©KIÓėKBrO3ĪļÖŹµÄĮæ¹ŲĻµĪŖn£ØKI£©”Ż6n£ØKBrO3£©Ź±£¬KIŅ»¶Ø¹żĮ棬ĄķÓÉŹĒ________”£
£Ø6£©¢õÖŠµĪ¶ØÖĮÖÕµćµÄĻÖĻóŹĒ_____________________________”£
£Ø7£©·ĻĖ®ÖŠ±½·ÓµÄŗ¬ĮæĪŖ___________g”¤L1£Ø±½·ÓĦ¶ūÖŹĮæ£ŗ94 g”¤mol 1£©”£
£Ø8£©ÓÉÓŚBr2¾ßÓŠ____________ŠŌÖŹ£¬¢ņ~¢ōÖŠ·“Ó¦ŠėŌŚĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬·ńŌņ»įŌģ³É²ā¶Ø½į¹ūĘ«øß”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÖø¶Ø·“Ó¦µÄĄė×Ó·½³ĢŹ½ÕżČ·µÄŹĒ
A. ŹŅĪĀĻĀÓĆĻ”NaOHČÜŅŗĪüŹÕCl2£ŗCl2+2OH![]() ClO+Cl+H2O
ClO+Cl+H2O
B. ÓĆĀĮ·ŪŗĶNaOHČÜŅŗ·“Ó¦ÖĘȔɣĮæH2£ŗAl+2OH![]()
![]() +H2ӟ
+H2ӟ
C. ŹŅĪĀĻĀÓĆĻ”HNO3ČܽāĶ£ŗCu+2![]() +2H+
+2H+![]() Cu2++2NO2ӟ+H2O
Cu2++2NO2ӟ+H2O
D. ĻņNa2SiO3ČÜŅŗÖŠµĪ¼ÓĻ”ŃĪĖį£ŗNa2SiO3+2H+![]() H2SiO3”ż+2Na+
H2SiO3”ż+2Na+
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ“ĪĮ×Ėį(H3PO2)ŹĒŅ»ÖÖ¾«ĻøĮ׻ƹ¤²śĘ·£¬¾ßÓŠ½ĻĒ滹ŌŠŌ”£»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©H3PO2ŹĒŅ»ŌŖÖŠĒæĖį£¬Š“³öĘäµēĄė·½³ĢŹ½____”£
£Ø2£©H3PO2¼°NaH2PO2¾łæɽ«ČÜŅŗÖŠµÄAg+»¹ŌĪŖŅų£¬“Ó¶ųæÉÓĆÓŚ»Æѧ¶ĘŅų”£
¢ŁH3PO2ÖŠPŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ___”£
¢Ś ĄūÓĆH3PO2½ųŠŠ»Æѧ¶ĘŅų·“Ó¦ÖŠ£¬Ńõ»Æ¼ĮÓė»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®±ČĪŖ4”Ć1£¬ŌņŃõ»Æ²śĪļĪŖ__________(Ģī»ÆѧŹ½)”£
¢Ū“Ó·ÖĄąĄ“æ“£¬NaH2PO2ŹōÓŚ______
a£®ÕżŃĪ b£®ĖįŹ½ŃĪ c£®ÄĘŃĪ d£®Ńõ»ÆĪļ
£Ø3£©H3PO2µÄ¹¤ŅµÖĘ·ØŹĒ£ŗ½«°×Į×(P4)ÓėBa(OH)2ČÜŅŗ·“Ӧɜ³ÉPH3ĘųĢåŗĶBa(H2PO2)2£¬ŗóÕßŌŁÓėH2SO4·“Ó¦”£Š“³ö°×Į×ÓėBa(OH)2ČÜŅŗ·“Ó¦µÄ»Æѧ·½³ĢŹ½_______Ba(H2PO2)2ÓėH2SO4µÄĄė×Ó·½³ĢŹ½___________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æCu2+ÄÜÓėNH3”¢H2O”¢OH©”¢Cl©µČŠĪ³ÉÅäĪ»ŹżĪŖ4µÄÅäŗĻĪļ”£
£Ø1£©ĻņCuSO4ČÜŅŗÖŠ¼ÓČė¹żĮæNaOHČÜŅŗæÉÉś³ÉNa2[Cu£ØOH£©4]”£
¢Ł»³öÅäĄė×Ó[Cu£ØOH£©4]2+ÖŠµÄÅäĪ»¼ü__”£
¢ŚNa2[Cu£ØOH£©4]ÖŠ³żĮĖÅäĪ»¼üĶā£¬»¹“ęŌŚµÄ»Æѧ¼üĄąŠĶÓŠ__£ØĢīŠņŗÅ£©”£
A£®Ąė×Ó¼ü B£®½šŹō¼ü C£®¼«ŠŌ¹²¼Ū¼ü D£®·Ē¼«ŠŌ¹²¼Ū¼ü
£Ø2£©½šŹōĶµ„¶ĄÓė°±Ė®»ņ¹żŃõ»ÆĒā¶¼²»ÄÜ·“Ó¦£¬µ«æÉÓė°±Ė®ŗĶ¹żŃõ»ÆĒāµÄ»ģŗĻČÜŅŗ·¢ÉśČēĻĀ·“Ó¦£ŗCu+H2O2+4NH3ØT[Cu£ØOH£©4]2++2OH©”£ĘäŌŅņŹĒ_________________£®
£Ø3£©Cu2+æÉŅŌÓėŅŅ¶ž°·£ØH2N©CH2CH2©NH2£©ŠĪ³ÉÅäĄė×Ó£ØČēĶ¼£©£ŗ

¢ŁH”¢O”¢NČżÖÖŌŖĖŲµÄµēøŗŠŌ“ӓ󵽊”µÄĖ³Šņ____”£
¢ŚŅŅ¶ž°··Ö×ÓÖŠNŌ×ӳɼüŹ±²ÉČ”µÄŌÓ»ÆĄąŠĶŹĒ__”£
¢ŪŅŅ¶ž°··ŠµćøßÓŚCl©CH2CH2©ClµÄÖ÷ŅŖŌŅņŹĒ__”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÉčNA±ķŹ¾°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ”£ĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ
A. ±ź×¼×“æöĻĀ£¬2.24L±½ÖŠŗ¬ÓŠĢ¼Ģ¼Ė«¼üŹżĪŖ0.3NA
B. 6.4gS2”¢S4ŗĶS8µÄ»ģŗĻĪļÖŠĖłŗ¬ĮņŌ×ÓŹżĪŖ0.2NA
C. 1L0.1mol”¤L-1µÄĒāµāĖįÖŠŗ¬µā»ÆĒā·Ö×ÓŹżĪŖ0.1NA
D. 60gŅŅĖįÓė×ćĮæŅŅ“¼·¢Éśõ„»Æ·“Ó¦Ź±¶ĻĮѵÄC-O¼üŹżĪŖNA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æij»ÆѧŠĖȤŠ”×éÓūŃ”ÓĆĻĀĮŠ×°ÖĆŗĶŅ©Ę·ÖĘČ”“æ¾»ŅŅČ²²¢½ųŠŠÓŠ¹ŲŅŅČ²ŠŌÖŹµÄĢ½¾æ£¬ŹŌ»Ų“šĻĀĮŠĪŹĢā”£

£Ø1£©AÖŠÖĘČ”ŅŅČ²µÄ»Æѧ·½³ĢŹ½ĪŖ_______________________________________________”£
£Ø2£©ÖĘŅŅČ²Ź±£¬ŠżæŖ·ÖŅŗĀ©¶·µÄ»īČū£¬Ź¹Ė®»ŗĀżµĪĻĀµÄŌŅņŹĒ________________________£¬·ÖŅŗĀ©¶·ĄļµÄŅŗĢåĶس£ÓĆ___________________”£
£Ø3£©ÓƵēŹÆÖʵƵÄŅŅČ²ÖŠ³£ŗ¬ÓŠH2S”¢PH3µČŌÓÖŹ£¬³żČ„ŌÓ֏ӦєÓĆ________£ØĢī×ÖÄø£¬ĻĀĶ¬£©×°ÖĆ£¬ĘųĢåÓ¦“Ó________½ų£»øÉŌļŅŅČ²×īŗĆŃ”ÓĆ________×°ÖĆ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÖø¶Ø·“Ó¦µÄĄė×Ó·½³ĢŹ½ÕżČ·µÄŹĒ(””””)
A. ĀČĘųČÜÓŚĖ®£ŗCl2+H2O2H++Cl©+ClO©
B. ĻņFeSO4ČÜŅŗÖŠ¼ÓČėH2SO4Ėį»ÆµÄKMnO4ČÜŅŗ£ŗ5Fe2++MnO4©+8H+ØT5Fe3++Mn2++4H2O
C. ĻņÉŁĮæ³ĪĒåŹÆ»ŅĖ®ÖŠ¼ÓČė×ćĮæµÄNaHCO3ČÜŅŗ£ŗCa2++OH©+HCO3©ØTCaCO3”ż+H2O
D. ÓĆĶ×öµē¼«µē½āNaClČÜŅŗ£ŗ2Cl©+2H2O![]() H2”ü+Cl2”ü+2OH©
H2”ü+Cl2”ü+2OH©
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com