
| A、常温下,pH=7的任何溶液中含有OH-数目均为10-7NA |
| B、23g乙醇中含有C-H键的数目为3NA |
| C、4.8g O2和O3以任何比例组成的混合气体中含有的氧原子数目均为0.3NA |
| D、常温常压下,2.24L Cl2与足量铁粉充分反应,转移的电子数目为0.2NA |
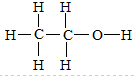 ,乙醇分子中存在5个碳氢键,0.5mol乙醇中含有2.5mol碳氢键;
,乙醇分子中存在5个碳氢键,0.5mol乙醇中含有2.5mol碳氢键;

科目:高中化学 来源: 题型:
| A、K+、H+、I-、ClO- |
| B、Na+、Fe3+、SO42-、OH- |
| C、Al3+、NH4+、AlO2-、NO3- |
| D、Mg2+、Ca2+、HCO3-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2与H2O反应:Cl2+H2O═2H++Cl-+ClO- |
| B、向氯化铁溶液中加氢碘酸能使溶液变为无色 |
| C、向NaClO溶液中通入少量的CO2:2ClO-+CO2+H2O═2HClO+CO32- |
| D、200mL 2mol/L的FeBr2溶液中通入11.2L标准状况下的Cl2:4Fe2++2Br-+5Cl2═4Fe3++3Br2+10Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca2+、K+、CO32-、Cl- |
| B、K+、NH4+、HCO3-、OH- |
| C、H+、Fe2+、ClO-、SO42- |
| D、Na+、Ba2+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯和乙烯都能与氢气发生加成反应 |
| B、淀粉和蛋白质都是人体重要的营养物质 |
| C、乙酸和乙醇都能与氢氧化钠溶液反应 |
| D、乙烯和甲烷可用酸性高锰酸钾溶液鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM2.5颗粒直径约是原子直径的2.5倍 |
| B、淀粉、蔗糖、氨基酸在一定条件都能发生水解反应 |
| C、植物油通常能和氢氧化钠溶液发生反应 |
| D、应该倡议禁止向绿色食品中添加任何化学物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |

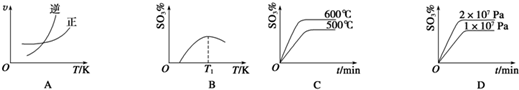
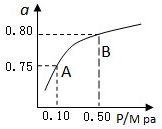
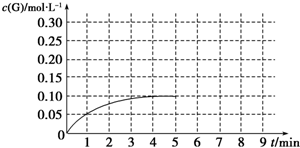
查看答案和解析>>
科目:高中化学 来源: 题型:
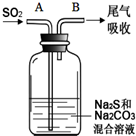 硫、氯及其化合物有广泛的用途.
硫、氯及其化合物有广泛的用途.| 资料:25℃时 | |
| H2CO3 | Ki1=4.4×10-7 |
| H2S | Ki1=1.3×10-7 |
| H2SO3 | Ki1=1.54×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
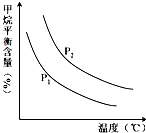 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
| n(H2O) |
| n(CH4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com