
| A. | 1molNH4+的质量为18g | |
| B. | SO2的摩尔质量为64g•mol-1 | |
| C. | 铝原子的摩尔质量等于它的相对原子质量 | |
| D. | 一个水分子的质量约等于$\frac{18}{6.02×1{0}^{23}}$g |
分析 A.NH4+的摩尔质量为18g/mol,根据m=nM计算;
B.摩尔质量在数值上等于相对分子质量;
C.摩尔质量在数值上等于相对分子质量,其单位为g/mol;
D.1mol水的质量为18g,据此可以求出一个水分子的质量.
解答 解:A.NH4+的摩尔质量为18g/mol,由m=nM,可知1molNH4+的质量为18g,故A正确;
B.摩尔质量在数值上等于相对分子质量,所以SO2的摩尔质量为64g•mol-1,故B正确;
C.摩尔质量在数值上等于相对原子质量,其单位为g/mol,则铝原子的摩尔质量在数值上等于它的相对原子质量,故C错误;
D.1mol水的质量为18g,则一个水分子的质量约等于$\frac{18}{6.02×1{0}^{23}}$g,故D正确.
故选C.
点评 本题考查物质的量的计算,侧重学生的分析、计算能力的考查,注意把握相关计算公式的运用,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钡溶液和盐酸 | B. | 硝酸银溶液和硝酸 | ||
| C. | 氯化钡溶液和硝酸银溶液 | D. | 硝酸钡溶液和硝酸银溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒有4种 | |
| B. | X、Y、Z可以形成离子化合物 | |
| C. | Y和Z分别形成的简单离子,其离子半径为Y>Z | |
| D. | Y和Z可以组成一种Y和Z的质量比为7:20的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能存在NaCl | B. | 可能存在Na2SO4 | C. | 一定存在FeCl3 | D. | 一定存在Ba(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150ml 1mol/L氯化钠溶液 | B. | 150ml 3mol/L氯化钾溶液 | ||
| C. | 75ml 2mol/L氯化铵溶液 | D. | 50ml 1mol/L氯化铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
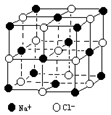 晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞.NaCl晶体结构如图所示.
晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞.NaCl晶体结构如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com