
【题目】向甲、乙两个容积均为1 L的恒容容器中。现向甲中充入2 mol A、2 mol B,乙中充入1 mol A、1 mol B。相同温度下发生反应:A(g)+B(g) ![]() xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是 ( )
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是 ( )


A. x不可能等于1
B. 甲、乙两容器中反应达平衡时,平衡常数K甲<K乙
C. 将乙容器升温可使甲、乙容器内各物质的体积分数相同
D. 若向甲容器中再充入2 mol A、2 mol B,则平衡时甲中0.78 mol·L-1<c(A)<1.56 mol·L-1
【答案】D
【解析】由题目数据可以计算:甲中反应物A的浓度由2 mol·L-1转化为0.78 mol·L-1,所以甲中A的转化率为61%;乙中反应物A的浓度由1 mol·L-1转化为0.5 mol·L-1,所以乙中A的转化率为50%。得到结论甲的平衡态比乙更向右。恒容下,甲的投料量是乙的2倍,相当于增大压强,而甲比乙的平衡态更向右,说明增大压强平衡向右,所以x=1,选项A错误。温度相同,平衡常数K必然相同,选项B错误。正反应放热,乙升高温度使乙中平衡向左移动,而原来甲就比乙的平衡态更向右,乙中平衡向左移动会使甲乙的平衡态相距越来越远,选项C错误。若向甲容器中再充入2 mol A、2 mol B,相当于将甲中投料量翻倍,如果建立相同平衡态,则平衡态也应该翻倍即c(A)为1.56 mol·L-1,但是恒容下投料量翻倍相当于增大压强,本题平衡向正反应方向移动,c(A)减小,但是一定会大于原来平衡态的浓度,即0.78 mol·L-1<c(A)<1.56 mol·L-1,选项D正确。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在下列溶液中Cl-的物质的量浓度最大的是
A. 0.5L 0.1mol/L的NaCl溶液 B. 100mL 0.2mol/L的MgCl2溶液
C. 1L 0.2mol/L的AlCl3溶液 D. 1L 0.3 mol/L盐酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与强酸反应又能与强碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏。请回答下列问题:
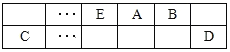
(1)A元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为_____________。
(2)同温同压下,将a L A氢化物的气体和b L D的氢化物气体先后通入一盛水的烧杯中,若所得溶液的pH=7,则a_________b(填“>"或“<”或“=”)。
(3)常温下,相同浓度F、G简单离子的溶液中滴加NaOH溶液,F、G两元素先后沉淀,F(OH)n完全沉淀的pH是4.7,G(OH)n完全沉淀的pH是2.8,则在相同条件下,溶解度较大的是:___(填化学式)。
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有:_______________。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
(5)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是______。
(6)用电子式表示B,C形成化合物C2B2的过程_______________。
(7)已知一定量的E单质能在B2(g)中燃烧,其可能的产物及能量关系如下图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式__________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物对人类的生产和生活有着重要的作用。一种由含硫化合物参与的制氢示意图如下:

(1)①反应2的化学方程式为___________;该反应能量转化的主要方式为_________。
②反应4的热化学方程式为2H2SO4(l)![]() 2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
已知:a. H2SO4(l)![]() SO3(g)+H2O(g) △H=X
SO3(g)+H2O(g) △H=X
b.2SO3(g)![]() 2SO2(g)+O2(g) △H=+196kJ/mol
2SO2(g)+O2(g) △H=+196kJ/mol
则X=____________。
(2)SO2是一种大气污染物,已知: 2SO2(g)+O2(g)![]() 2SO3(g) △H<0。
2SO3(g) △H<0。
①下列有关该反应速率的叙述正确的是_____________(填字母)。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强能增大活化分子百分数,加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
②该反应的化学平衡常数表达式为K=____________。
③下列有关图像一定正确的是__________(填字母)。

(3)现有甲、乙两个体积相等的恒容容器,甲容器中充入1molSO2和1molO2,乙容器中充入1molSO3和0.5molO2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0,甲、乙容器起始反应温度相同,两容器均为绝热容器,平衡时,甲容器中SO2的转化率为a,乙容器中SO3的分解率为b,则:
2SO3(g) △H<0,甲、乙容器起始反应温度相同,两容器均为绝热容器,平衡时,甲容器中SO2的转化率为a,乙容器中SO3的分解率为b,则:
①a+b__________1(填“<”、“>”或“=”)。
②下列叙述能说明甲容器中反应达平衡状态的是_______________(填字母)。
A.v正(O2)=2v逆(SO3) B.混合气体的密度不变
C.c(SO2)=c(SO3) D.混合气体的总物质的量不变
E.容器内温度不变 F.SO2和O2的质量比不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属晶体的判断正确的是( )
A.简单立方堆积、配位数6、空间利用率68%
B.体心立方堆积、配位数6、空间利用率68%
C.六方最密堆积、配位数8、空间利用率74%
D.面心立方最密堆积、配位数12、空间利用率74%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA 表示阿伏加德罗常数的值,下列说法正确的是
A. T ℃时,1 L pH=6的纯水中,含10-8NA个![]()
B. 15.6 g Na2O2与过量CO2反应时,转移的电子数为0.4NA
C. 1 mol SiO2中含有30 mol 电子
D. 14 g分子式为CnH2n的(n≥2)链烃中含有的C=C的数目一定为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.56gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标况),则反应消耗HNO3物质的量为( )
A.0.05 mol
B.1mol
C.0.13mol
D.1.05mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火法炼汞是在不太高的温度下(450~800℃),将汞矿石或精矿进行焙烧,直接将汞还原呈气态分离出来,而后冷凝成液态汞.目前工业上制粗汞的流程如图:

下列有关说法正确的是( )
A. 流程中加入氧化钙的目的是减少SO2的排放
B. “辰砂”加热时发生反应:HgS+O2 ![]() Hg+SO2,该方法属于热分解法
Hg+SO2,该方法属于热分解法
C. 洗涤粗汞时可用5%的盐酸代替5%的硝酸
D. 含汞烟气中汞的含量很低,可以直接排放
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com